Генератор AI для
Вікторини, картки
& Більше
Перетворіть свій нудний навчальний матеріал на інтерактивні аркуші на основі ШІ, тести, картки та практичні запитання одним натисканням кнопки. Завантажте PDF-файли, документи, аудіо та відео сьогодні, щоб почати.
Припиніть ручну роботу
Більшість студентів витрачають час на неефективні методи навчання
Замість того, щоб годинами перечитувати довгі документи чи вручну створювати картки та підсумки, ми допоможемо вам пропустити ці кроки.
Перестаньте потонути в інформації та дозвольте нашому штучному інтелекту відфільтрувати те, що дійсно важливо. Швидко почніть перевіряти себе та вдосконалюйтесь швидше.
Мало хто може дозволити собі особистого репетитора. StudyBlaze змінює це назавжди. Інтерактивне навчання робить ваш прогрес у 10 разів швидшим.
Створення навчальних матеріалів вручну – це час, який ви можете витратити на навчання та тестування. Зменшіть стрес, повністю виключивши ручну роботу.
Репетитор AI доступний цілодобово і без вихідних
Мати доступ до репетитора щодня
Миттєво отримуйте відгуки про свої відповіді
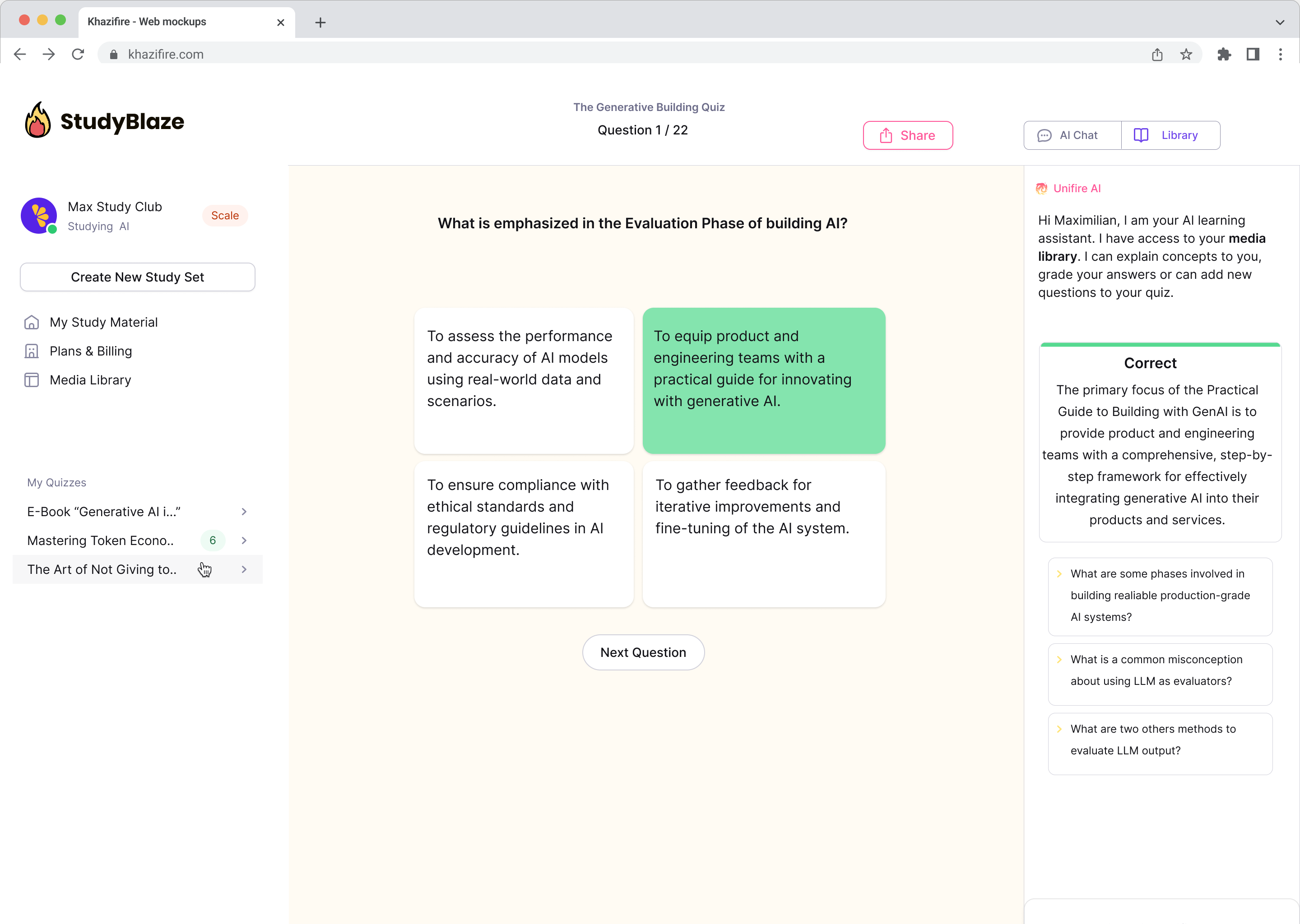
Спілкуйтеся зі своїми документами та швидше розумійте складні теми
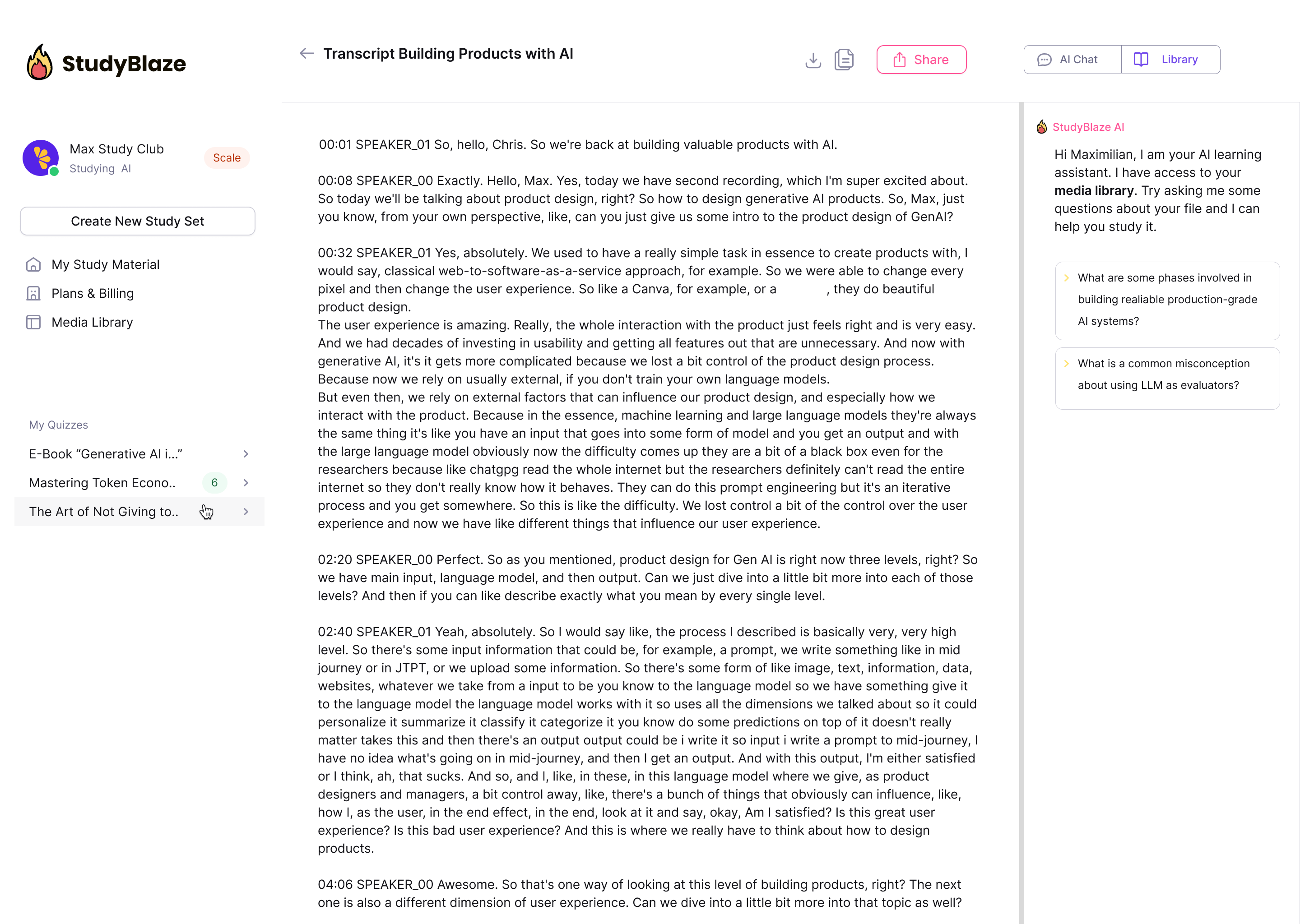
Дозвольте репетитеру ШІ оцінити ваші відповіді та розповісти, що ви пропустили
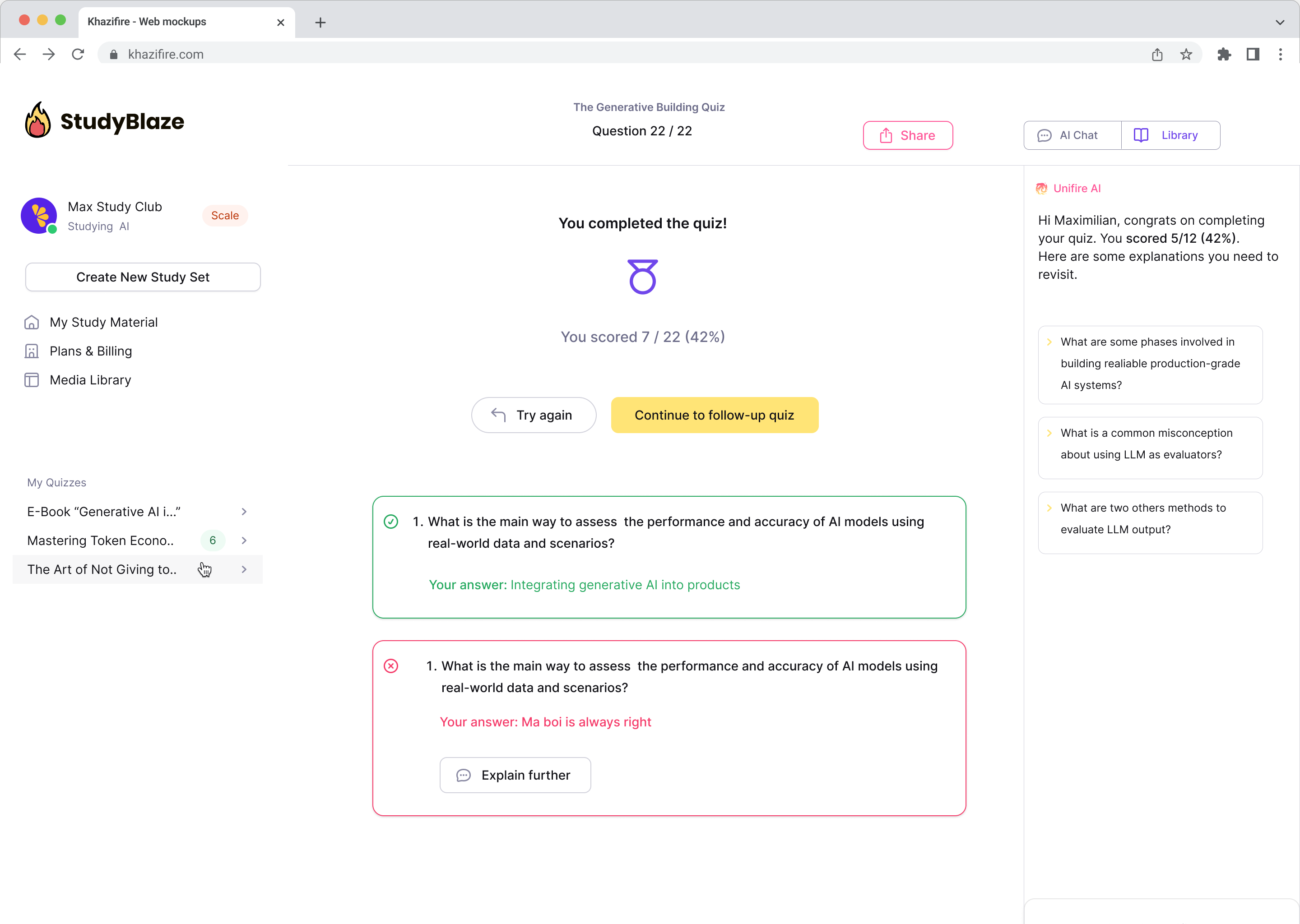
Найпопулярніші питання
Ми відповідаємо на найважливіші запитання таких користувачів, як ви.
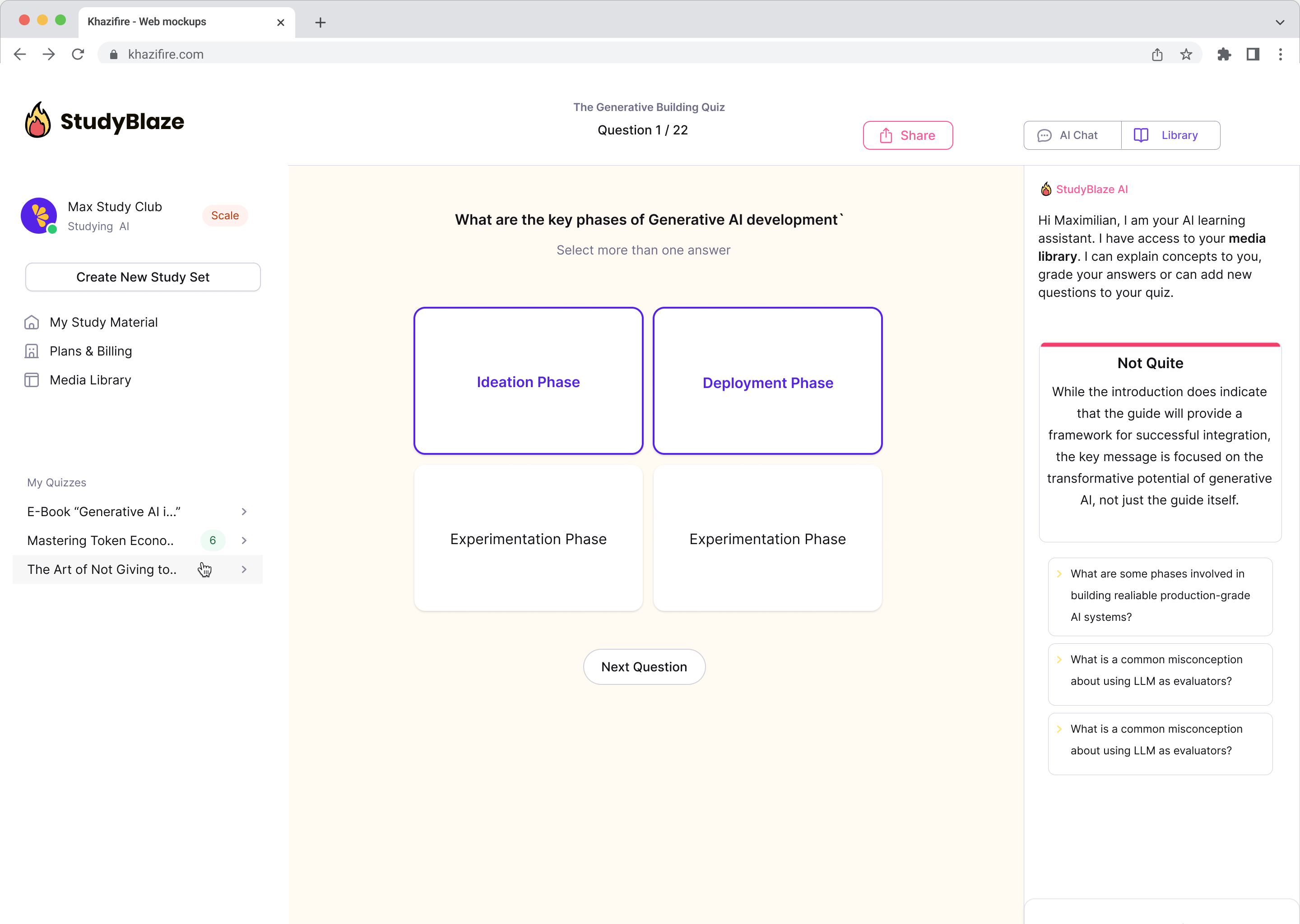
Оновіть свої звички до навчання
За допомогою StudyBlaze ви можете негайно покращити швидкість навчання. Замість того, щоб знову і знову читати нудні матеріали, перевірте свої знання швидше без годин ручного створення карток і резюме.
