АИ генератор за
Квизови, картице
& Више
Претворите свој досадни садржај учења у интерактивне радне листове, квизове, флеш картице и питања за вежбање једним кликом на дугме. Отпремите ПДФ-ове, документе, аудио и видео већ данас да бисте започели.
Зауставите ручни рад
Већина ученика губи време на неефикасне методе учења
Уместо да сатима поново читате своје дугачке документе или ручно креирате картице и резимее, ми вам помажемо да прескочите ове кораке.
Престаните да се давите у информацијама и дозволите нашој вештачкој интелигенцији да филтрира оно што је заиста важно. Брзо почните да се тестирате и побољшајте се брже.
Врло мало људи може приуштити личног ментора. СтудиБлазе ово мења заувек. Интерактивно учење чини ваш напредак 10 пута бржим.
Ручно креирање материјала за учење је време које можете потрошити на обуку и тестирање. Смањите стрес тако што ћете у потпуности елиминисати ручни рад.
АИ тутор доступан 24/7
Имајте приступ ментору сваки дан
Примите тренутне повратне информације о својим одговорима
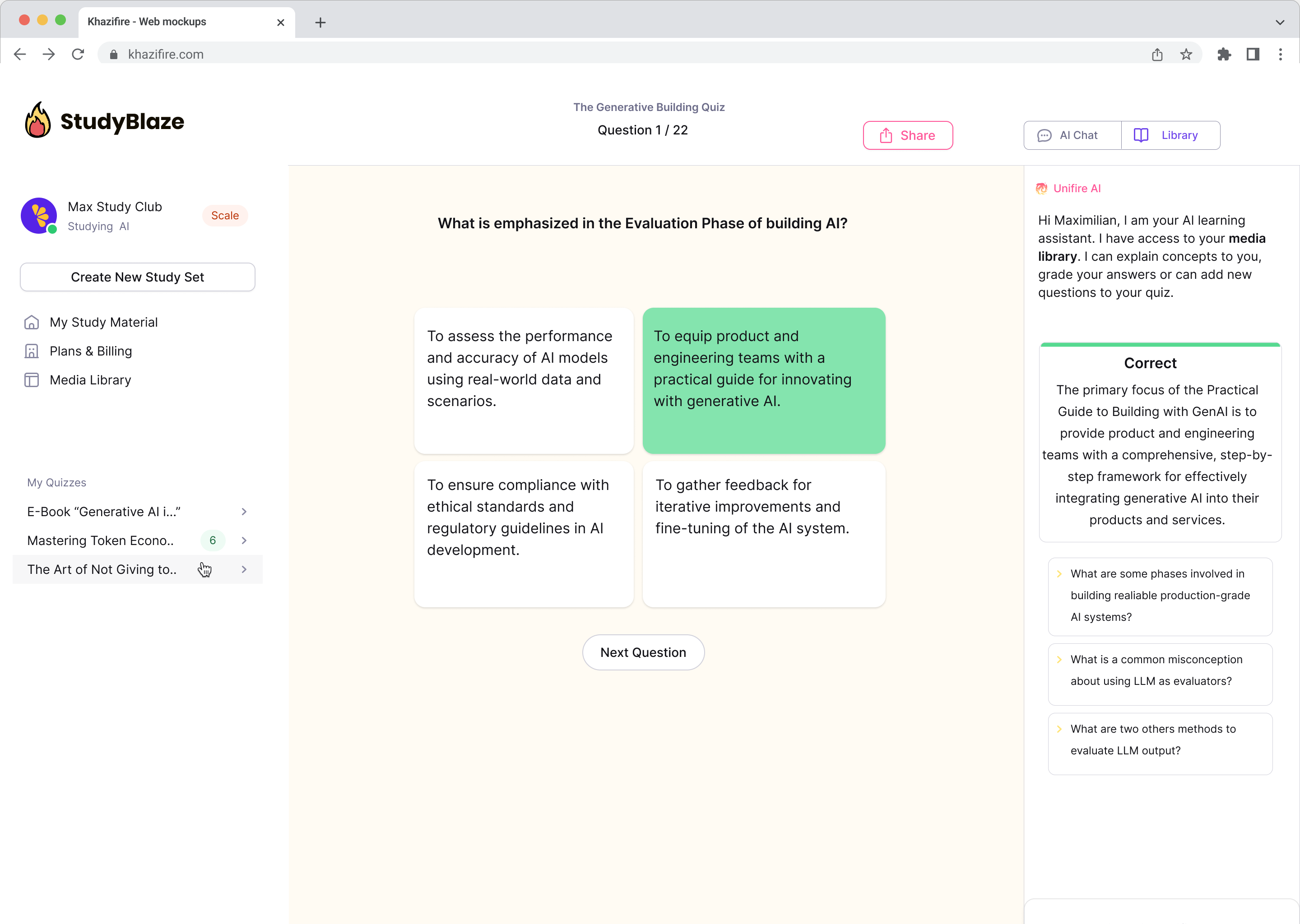
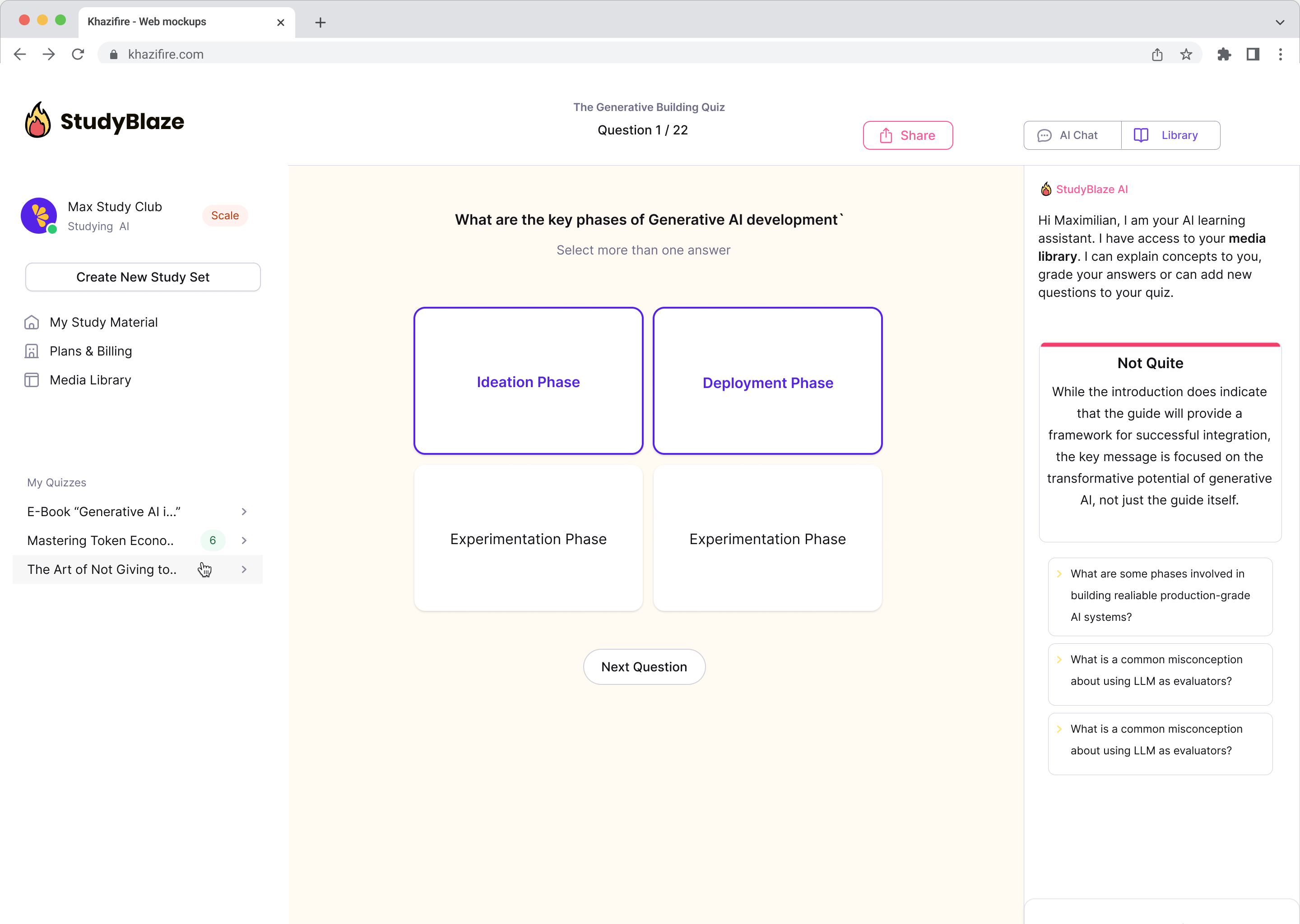
Разговарајте са својим документима и брже разумејте сложене теме
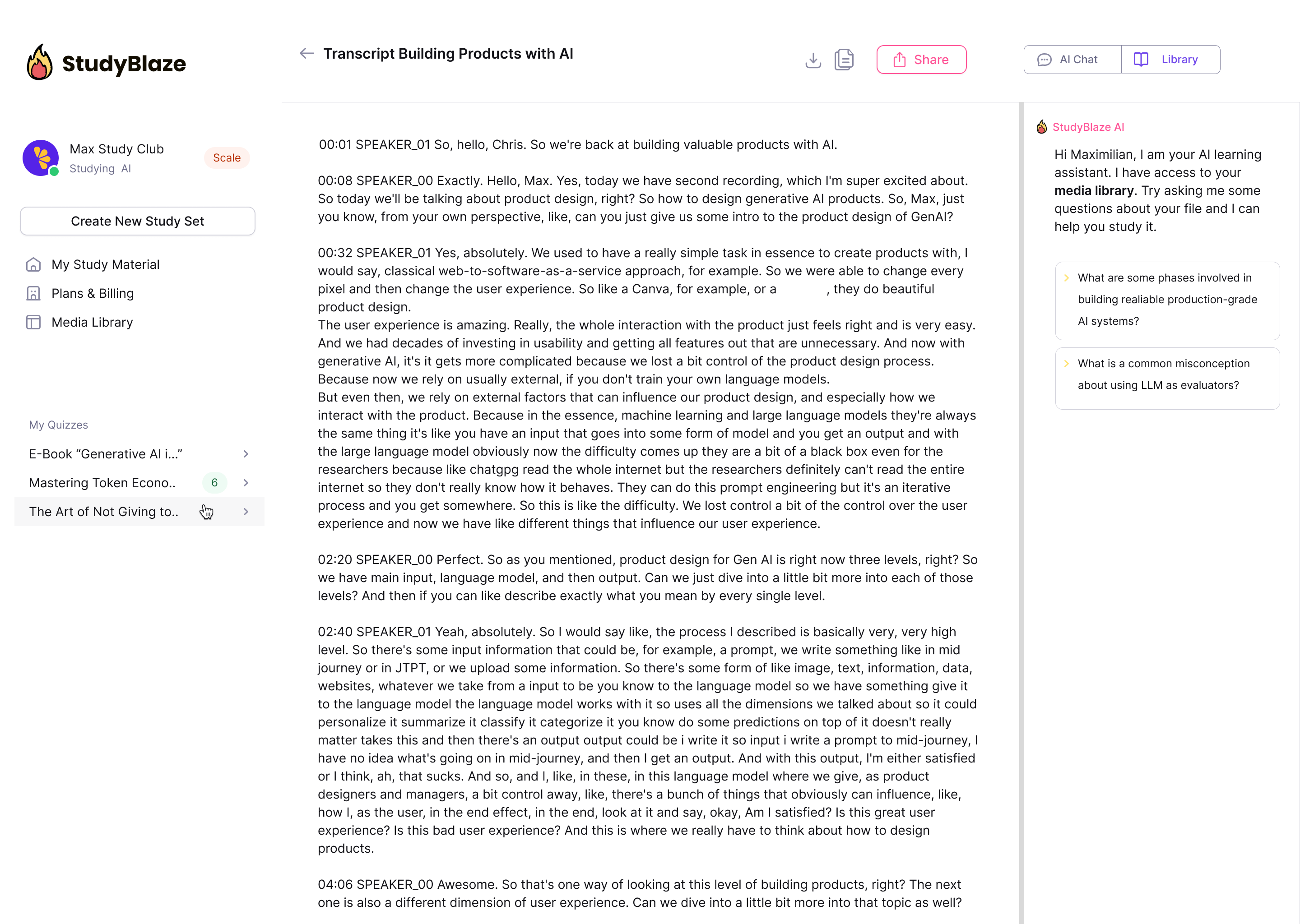
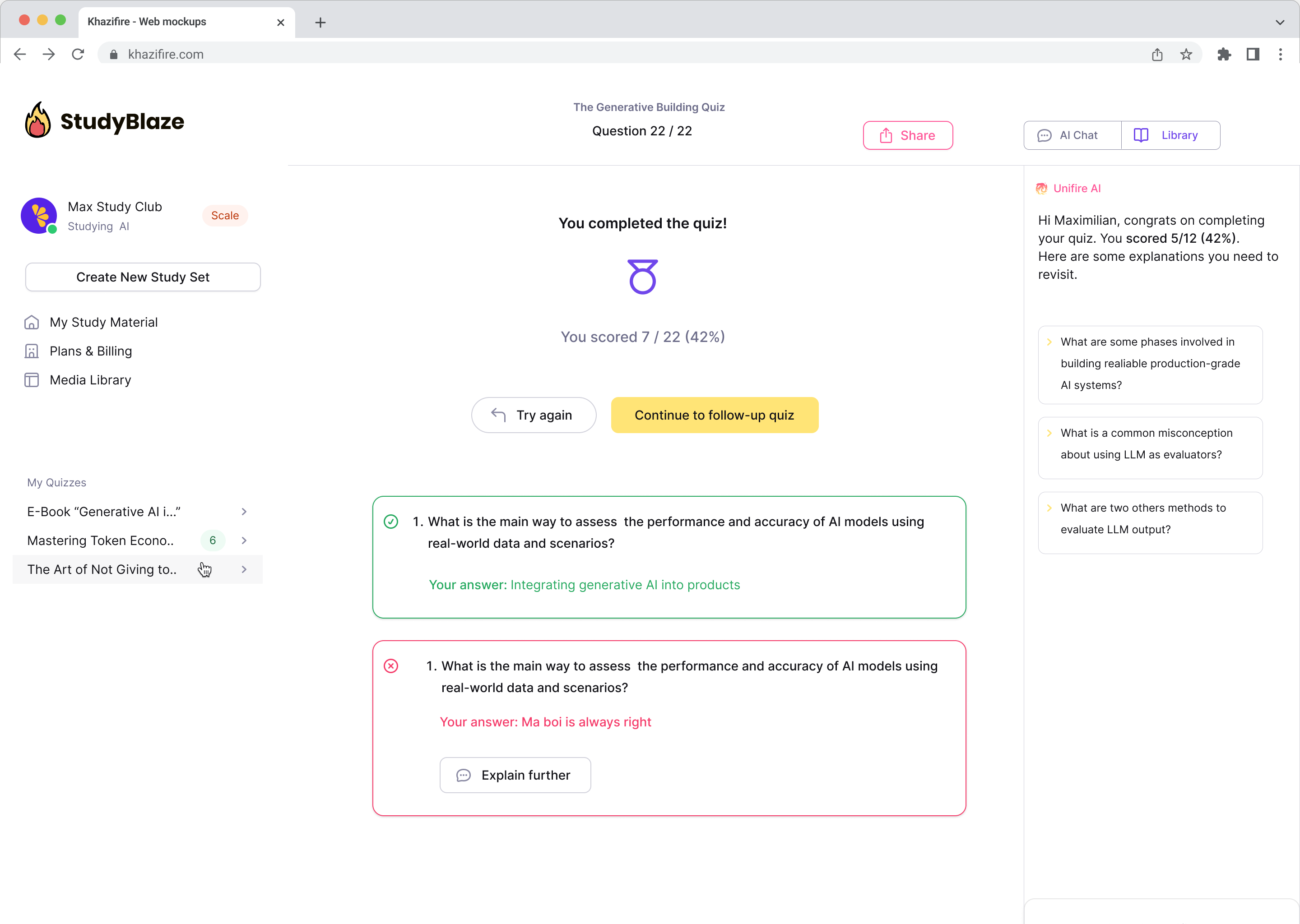
Нека ваш наставник АИ оцени ваше одговоре и каже вам шта сте пропустили
Најпопуларнија питања
Одговарамо на најважнија питања корисника попут вас.
Надоградите своје навике учења
Са СтудиБлазе можете одмах побољшати брзину учења. Уместо да изнова и изнова читате досадне материјале, брже тестирајте своје знање без сати ручног креирања флеш картице и резимеа.
