AI Generator za
Kvizi, kartice
& Več
Svojo dolgočasno študijsko vsebino spremenite v interaktivne delovne liste, ki jih poganja AI, kvize, kartice in vadbena vprašanja s klikom na gumb. Naložite PDF-je, dokumente, zvok in video še danes, da začnete.
Prenehajte z ročnim delom
Večina študentov zapravlja čas z neučinkovitimi učnimi metodami
Namesto ponovnega branja dolgih dokumentov ali ure in ure ročnega ustvarjanja kartic in povzetkov vam pomagamo preskočiti te korake.
Nehajte se utapljati v informacijah in pustite, da naša umetna inteligenca filtrira tisto, kar je res pomembno. Hitro se začnite preizkušati in se hitreje izboljšajte.
Zelo malo ljudi si lahko privošči osebnega učitelja. StudyBlaze to za vedno spremeni. Z interaktivnim učenjem je vaš napredek 10x hitrejši.
Ročno ustvarjanje učnega gradiva je čas, ki bi ga lahko porabili za usposabljanje in testiranje. Zmanjšajte stres tako, da popolnoma opustite ročno delo.
Učitelj umetne inteligence je na voljo 24/7
Imeti dostop do mentorja vsak dan
Prejmite takojšnje povratne informacije o svojih odgovorih
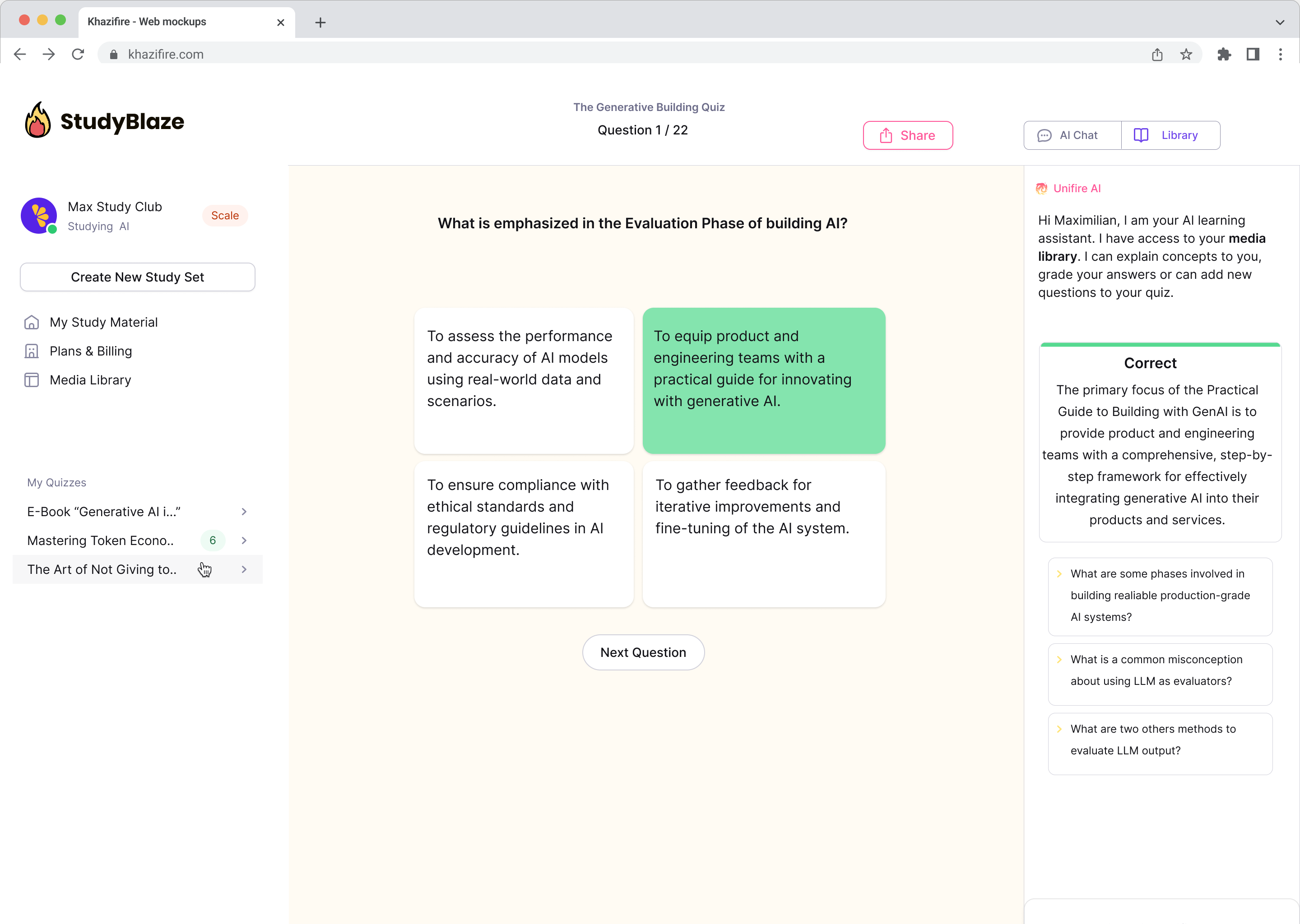
Klepetajte s svojimi dokumenti in hitreje razumejte zapletene teme
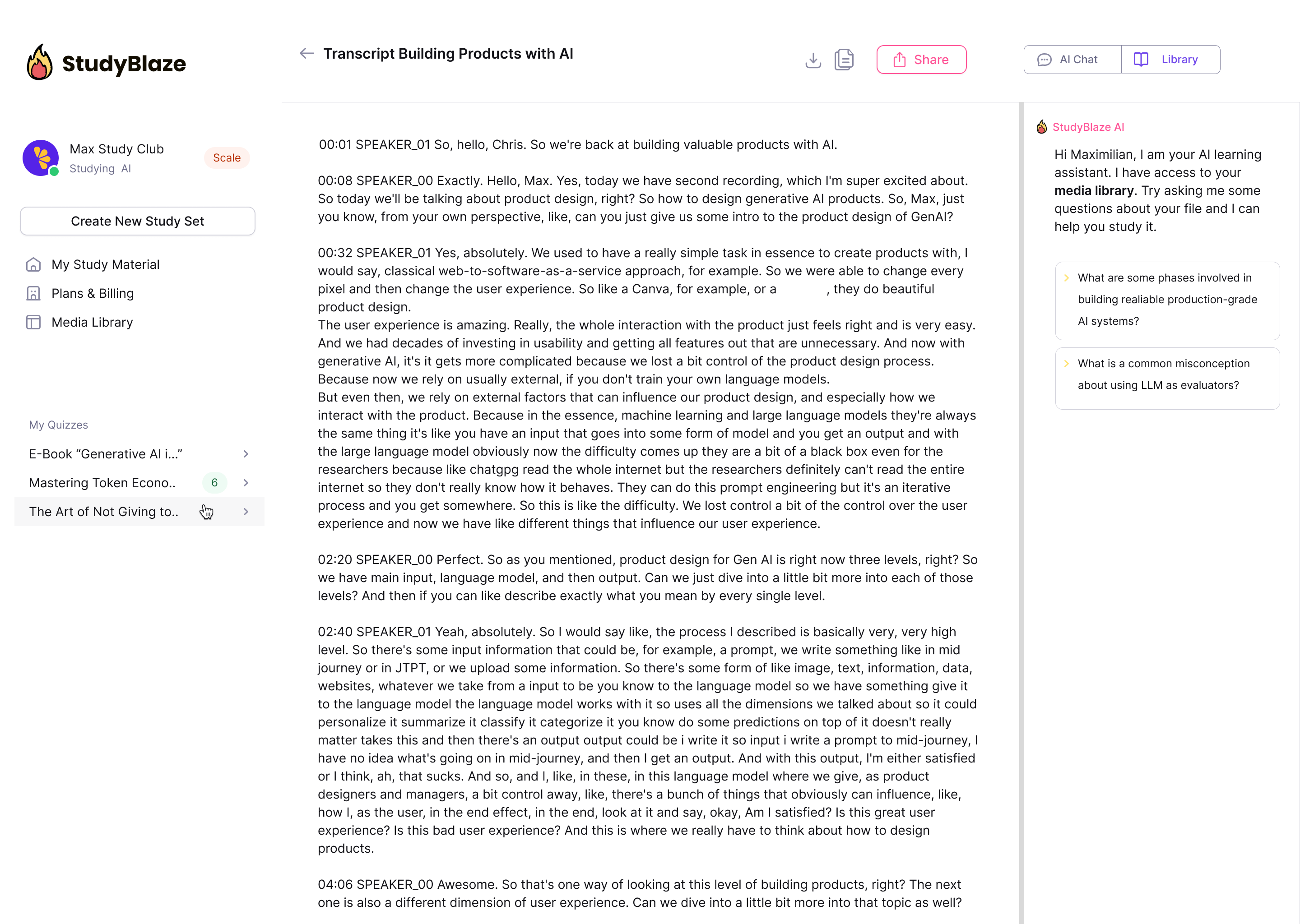
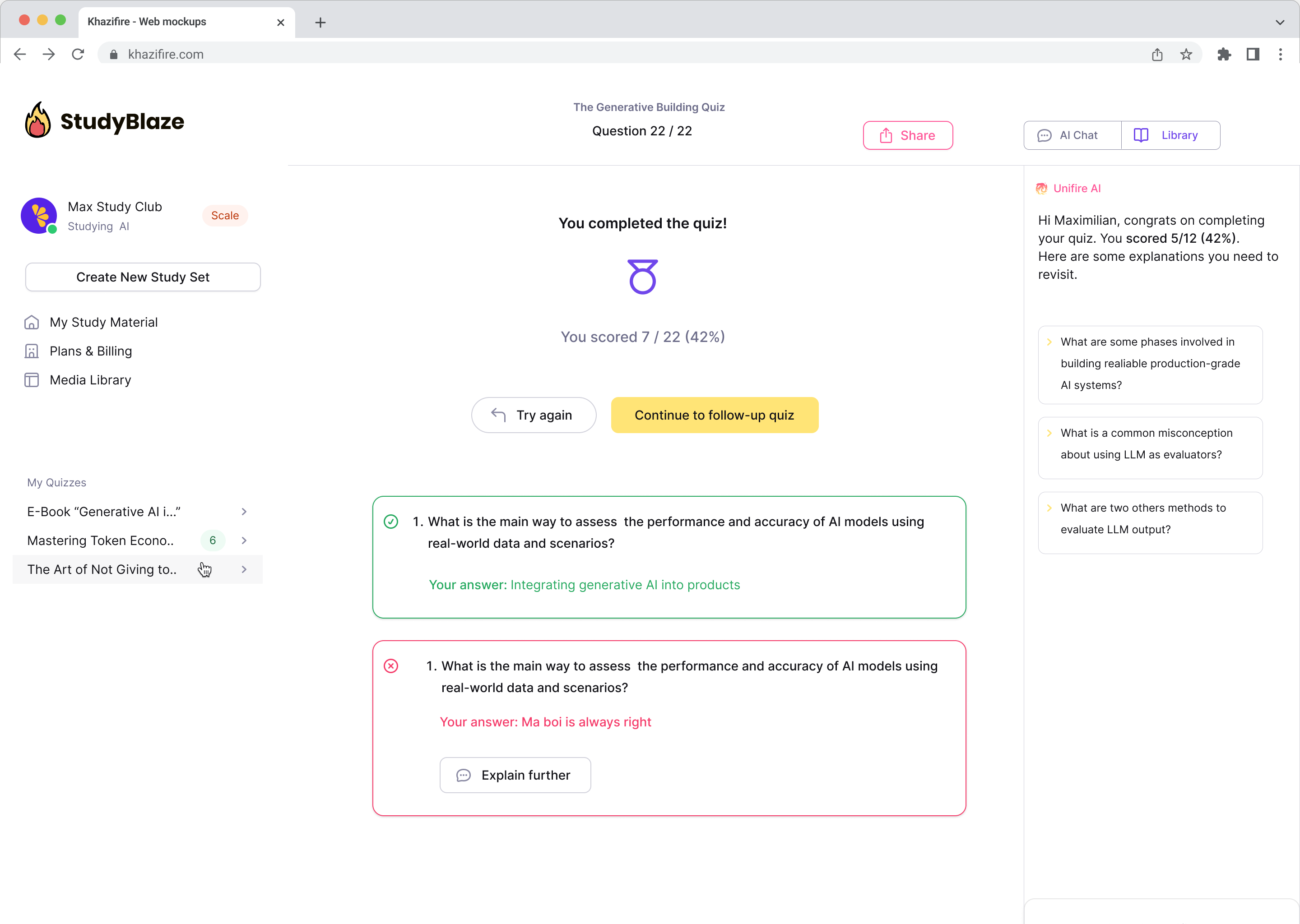
Naj vaš mentor AI oceni vaše odgovore in vam pove, kaj ste zamudili
Najbolj priljubljena vprašanja
Odgovarjamo na najpomembnejša vprašanja uporabnikov, kot ste vi.
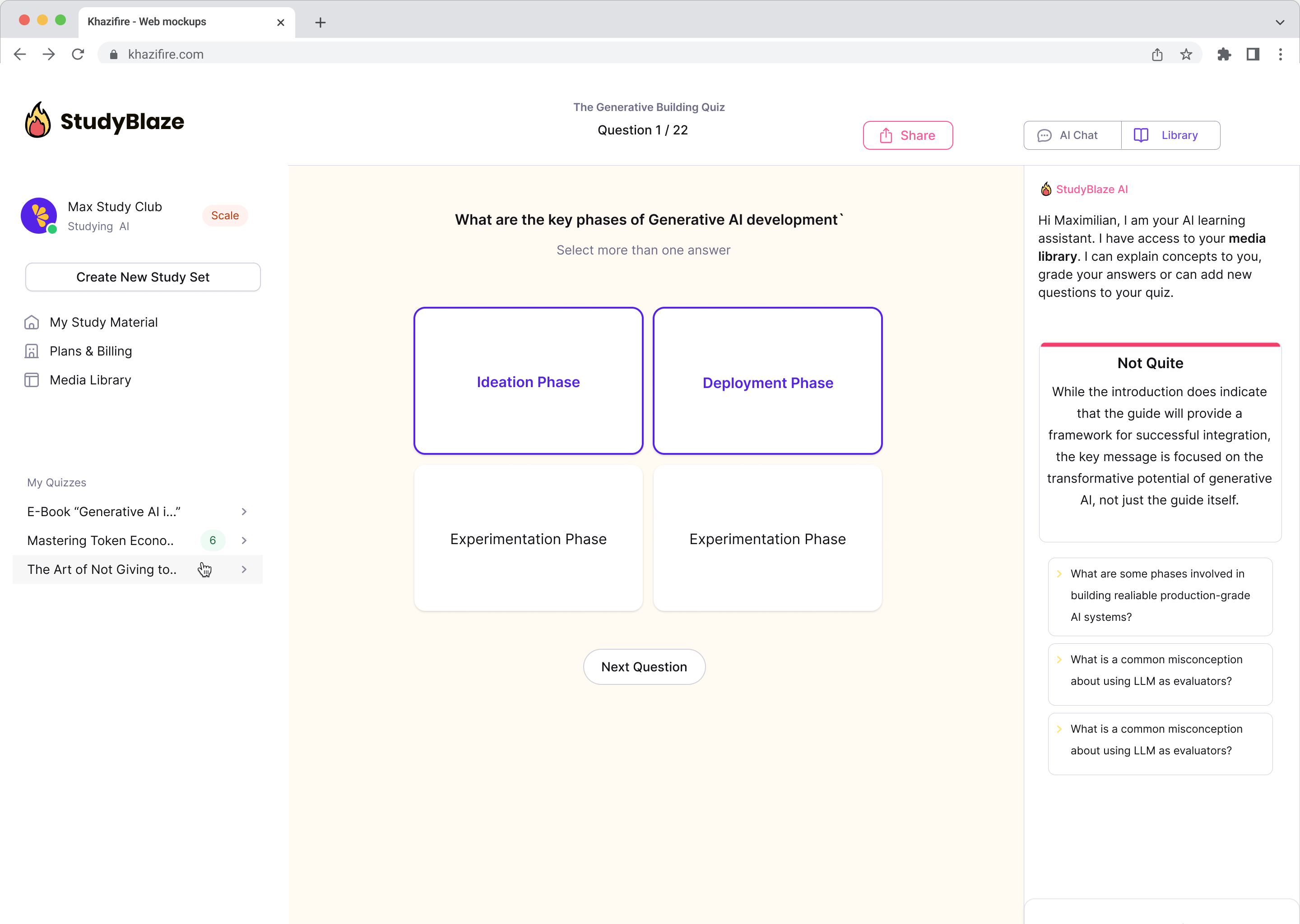
Nadgradite svoje učne navade
S StudyBlaze lahko takoj izboljšate svojo hitrost učenja. Namesto da vedno znova berete dolgočasna gradiva, hitreje preizkusite svoje znanje brez ur ročnega ustvarjanja kartic in povzetkov.
