Generator AI pentru
Chestionare, Flashcards
& Mai Mult
Transformă-ți conținutul plictisitor de studiu în foi de lucru interactive bazate pe inteligență artificială, chestionare, carduri și întrebări de exersare cu un clic pe un buton. Încărcați PDF-uri, documente, audio și video astăzi pentru a începe.
Opriți munca manuală
Majoritatea elevilor pierd timpul cu metode de învățare ineficiente
În loc să recitiți documentele lungi sau să creați manual carduri și rezumate ore întregi, vă ajutăm să săriți peste acești pași.
Nu vă mai înecați în informații și lăsați AI-ul nostru să filtreze ceea ce este cu adevărat important. Începeți rapid să vă testați și îmbunătățiți-vă mai repede.
Foarte puțini oameni își pot permite un tutor personal. StudyBlaze schimbă asta pentru totdeauna. Învățarea interactivă vă face progresul de 10 ori mai rapid.
Crearea manuală a materialelor de studiu este timpul pe care îl puteți petrece pregătindu-vă și testându-vă. Reduceți stresul eliminând complet munca manuală.
Un tutore AI disponibil 24/7
Aveți acces la un tutor în fiecare zi
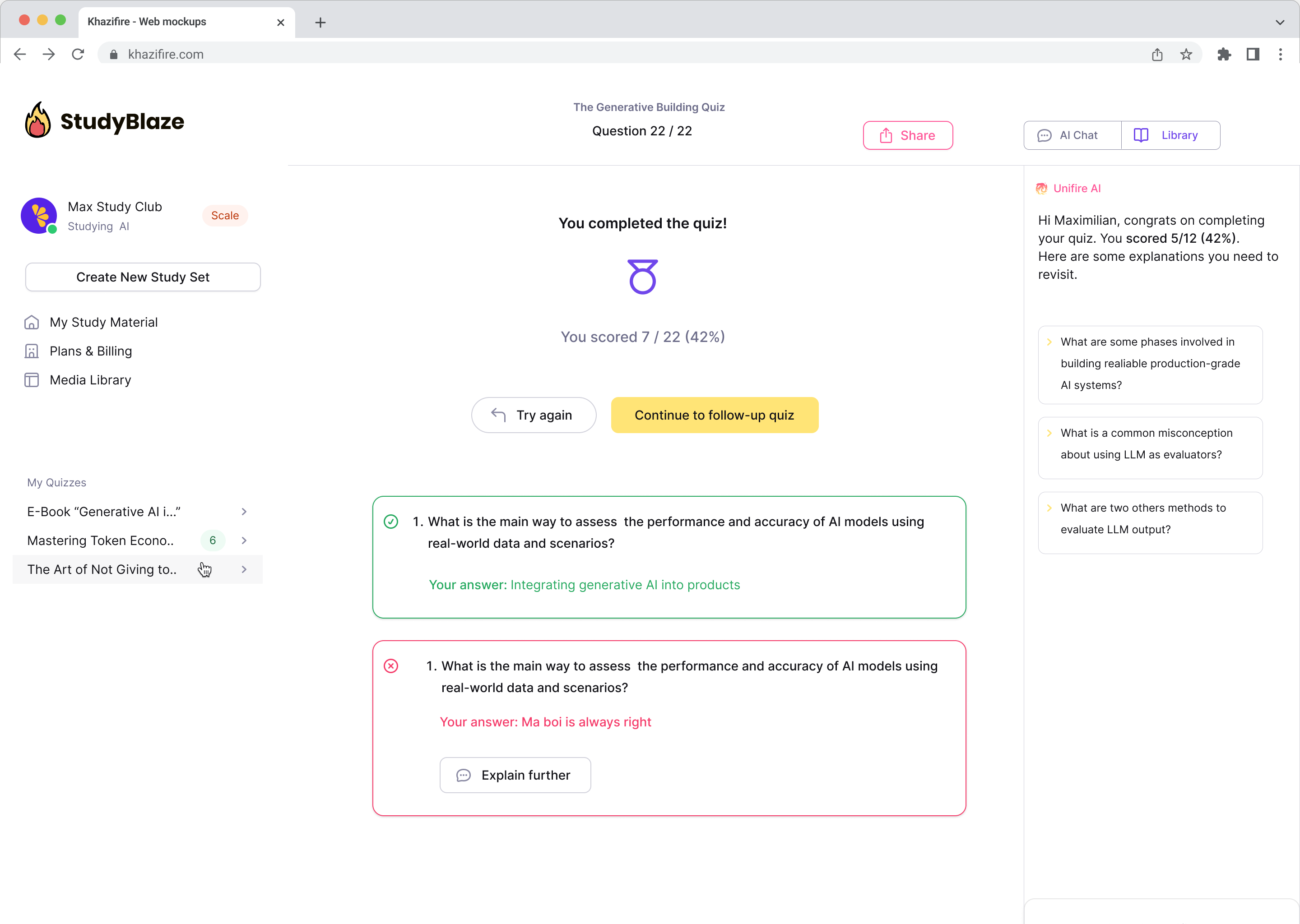
Primiți feedback instantaneu cu privire la răspunsurile dvs
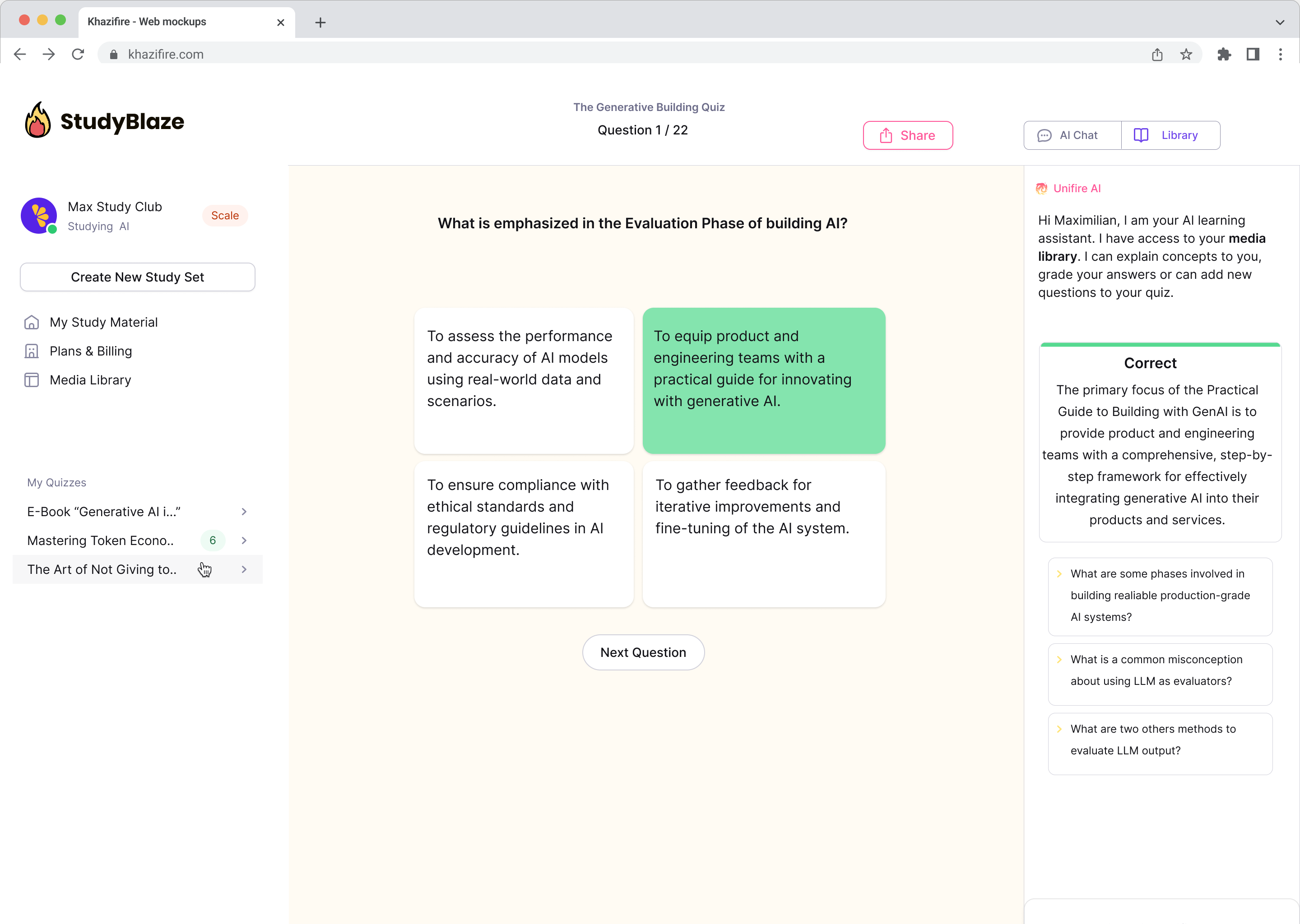
Discutați cu documentele dvs. și înțelegeți mai rapid subiectele complexe
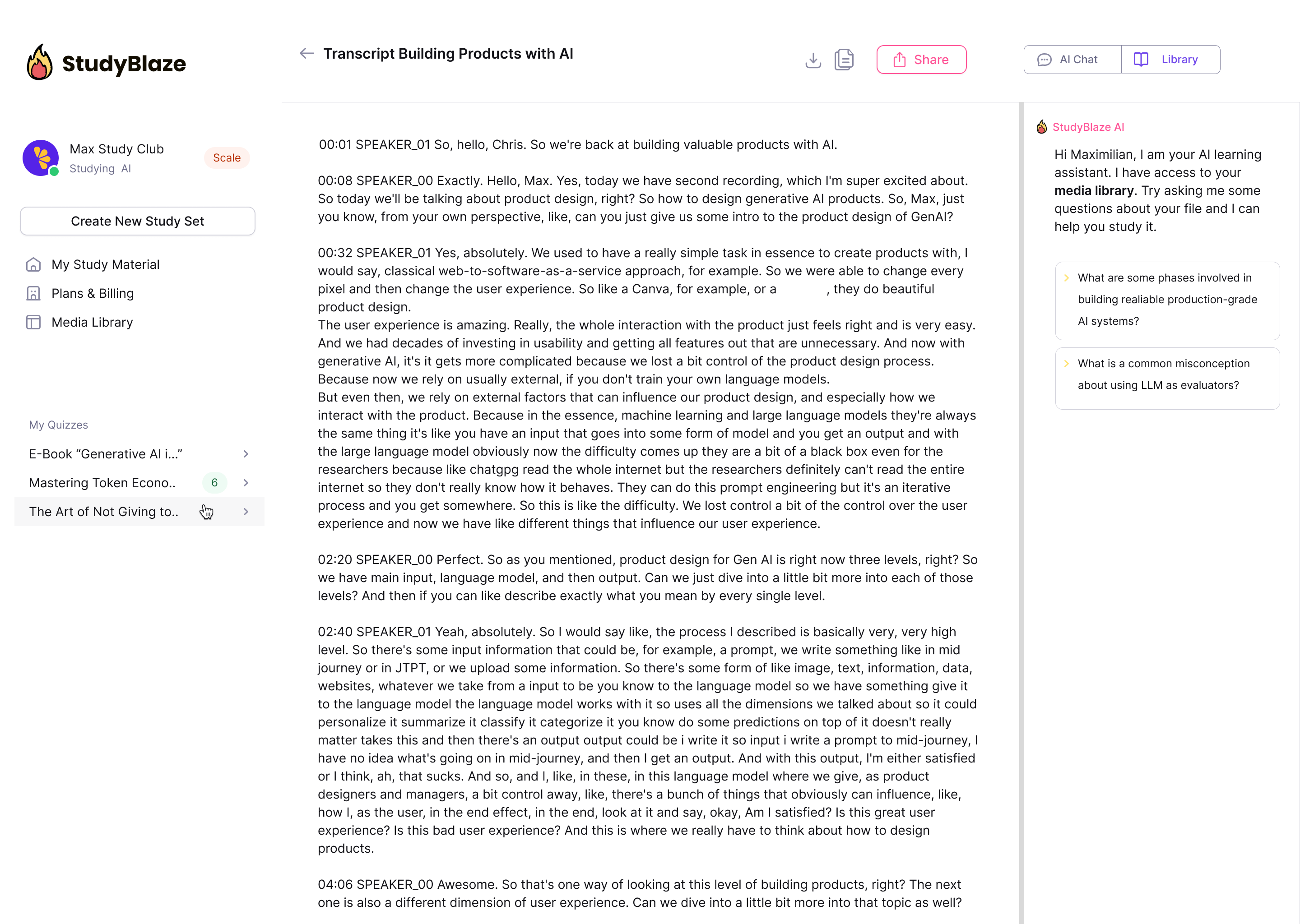
Lasă tutorele tău AI să-ți noteze răspunsurile și să-ți spună ce ai ratat
Cele mai populare întrebări
Răspundem la cele mai importante întrebări ale utilizatorilor ca tine.
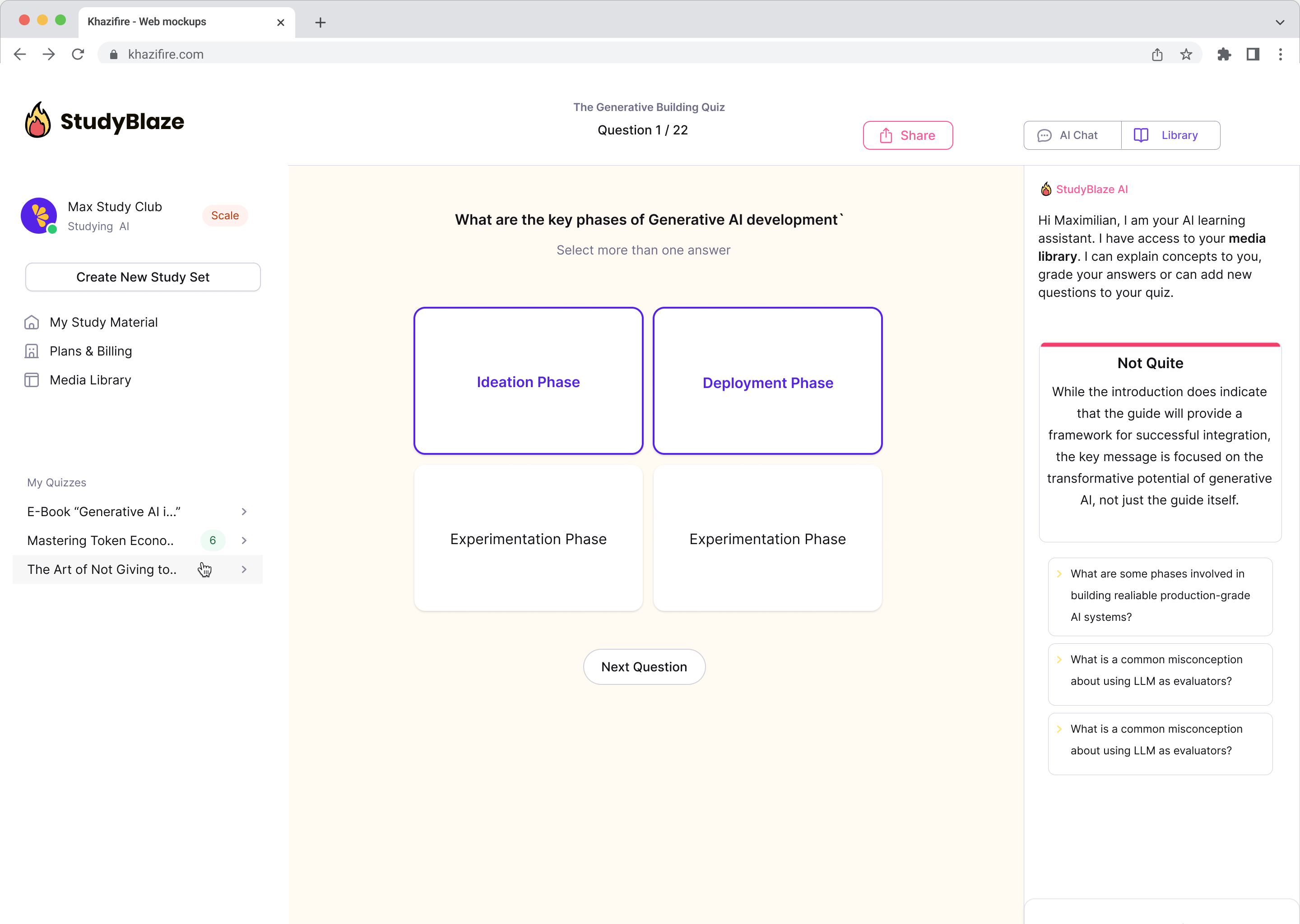
Îmbunătățiți-vă obiceiurile de studiu
Cu StudyBlaze vă puteți îmbunătăți imediat viteza de învățare. În loc să citiți materiale plictisitoare din nou și din nou, încercați-vă cunoștințele mai repede, fără ore de creare manuală a cardurilor și rezumatelor.
