Gerador de IA para
Questionários, Flashcards
& Mais
Transforme seu conteúdo de estudo chato em planilhas interativas alimentadas por IA, questionários, flashcards e questões práticas com um clique de um botão. Carregue PDFs, documentos, áudio e vídeo hoje para começar.
Pare o trabalho manual
A maioria dos alunos perde tempo com métodos de aprendizagem ineficientes
Em vez de reler seus documentos longos ou criar manualmente flashcards e resumos por horas, ajudamos você a pular essas etapas.
Pare de se afogar em informações e deixe nossa IA filtrar o que é realmente importante. Comece a testar a si mesmo rapidamente e melhore mais rápido.
Poucas pessoas podem pagar um tutor pessoal. O StudyBlaze muda isso para sempre. O aprendizado interativo torna seu progresso 10x mais rápido.
Criar manualmente materiais de estudo é tempo que você poderia gastar treinando e testando a si mesmo. Reduza o estresse eliminando o trabalho manual completamente.
Um tutor de IA disponível 24 horas por dia, 7 dias por semana
Tenha acesso a um tutor todos os dias
Receba feedback instantâneo sobre suas respostas
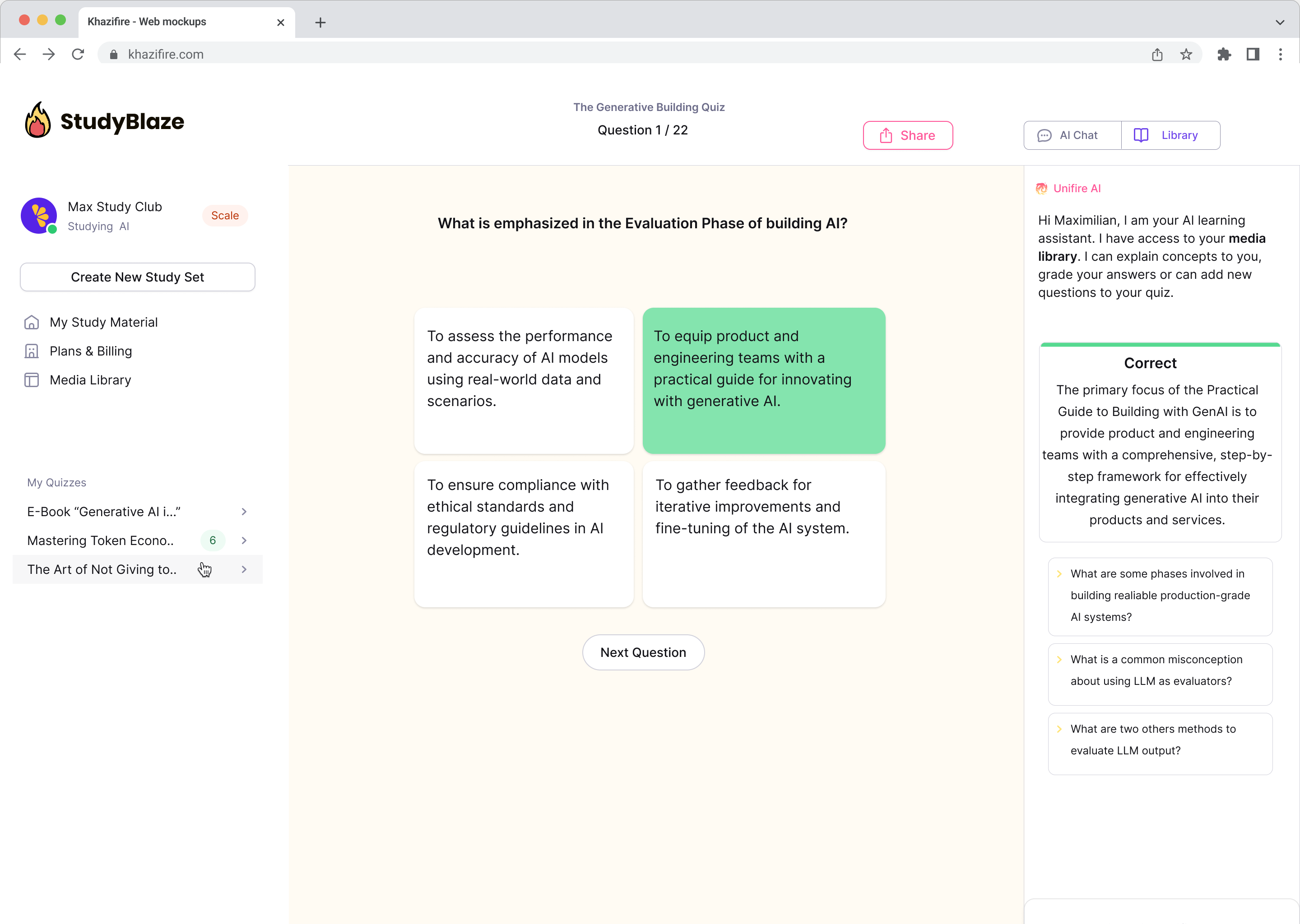
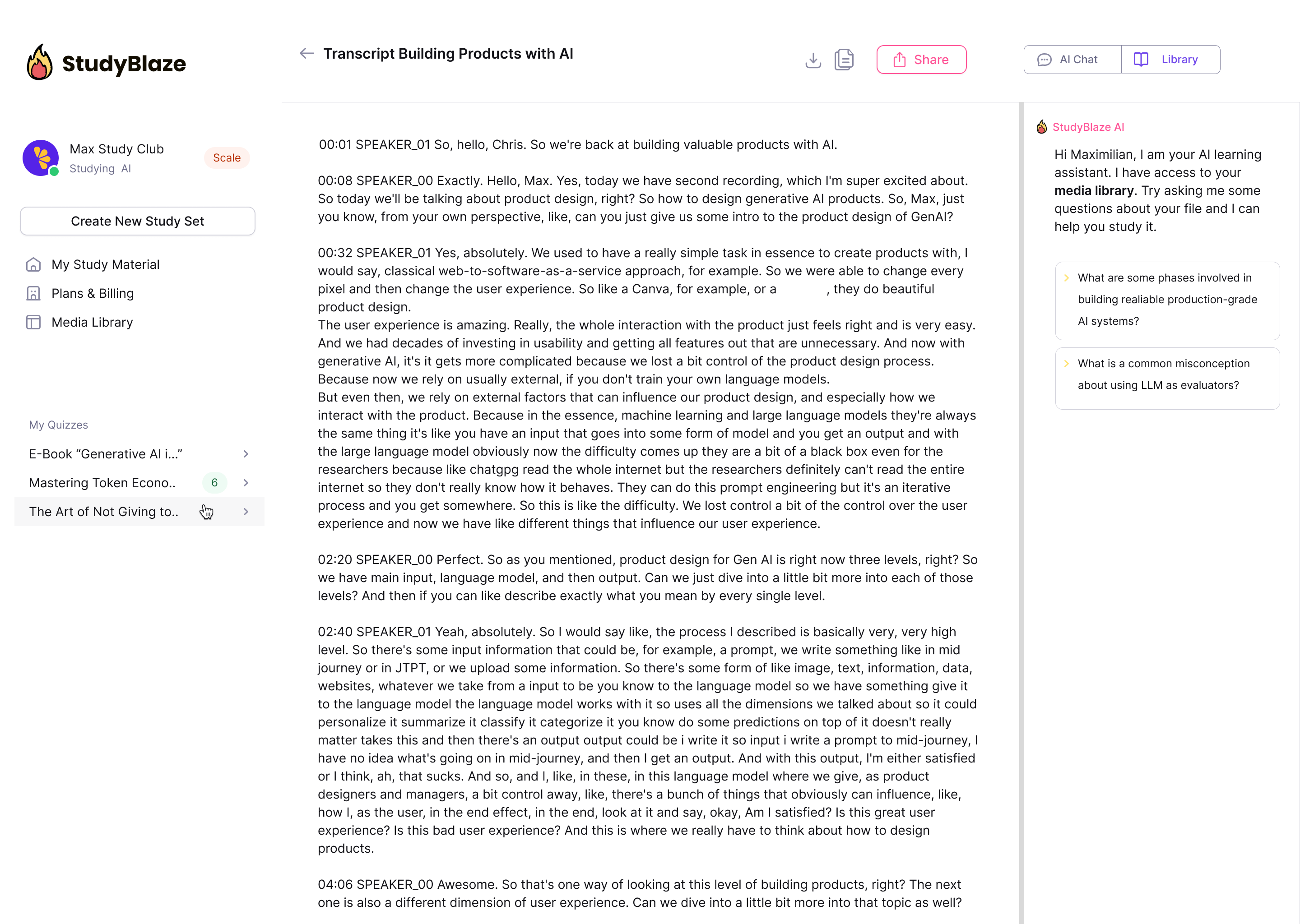
Converse com seus documentos e entenda tópicos complexos mais rapidamente
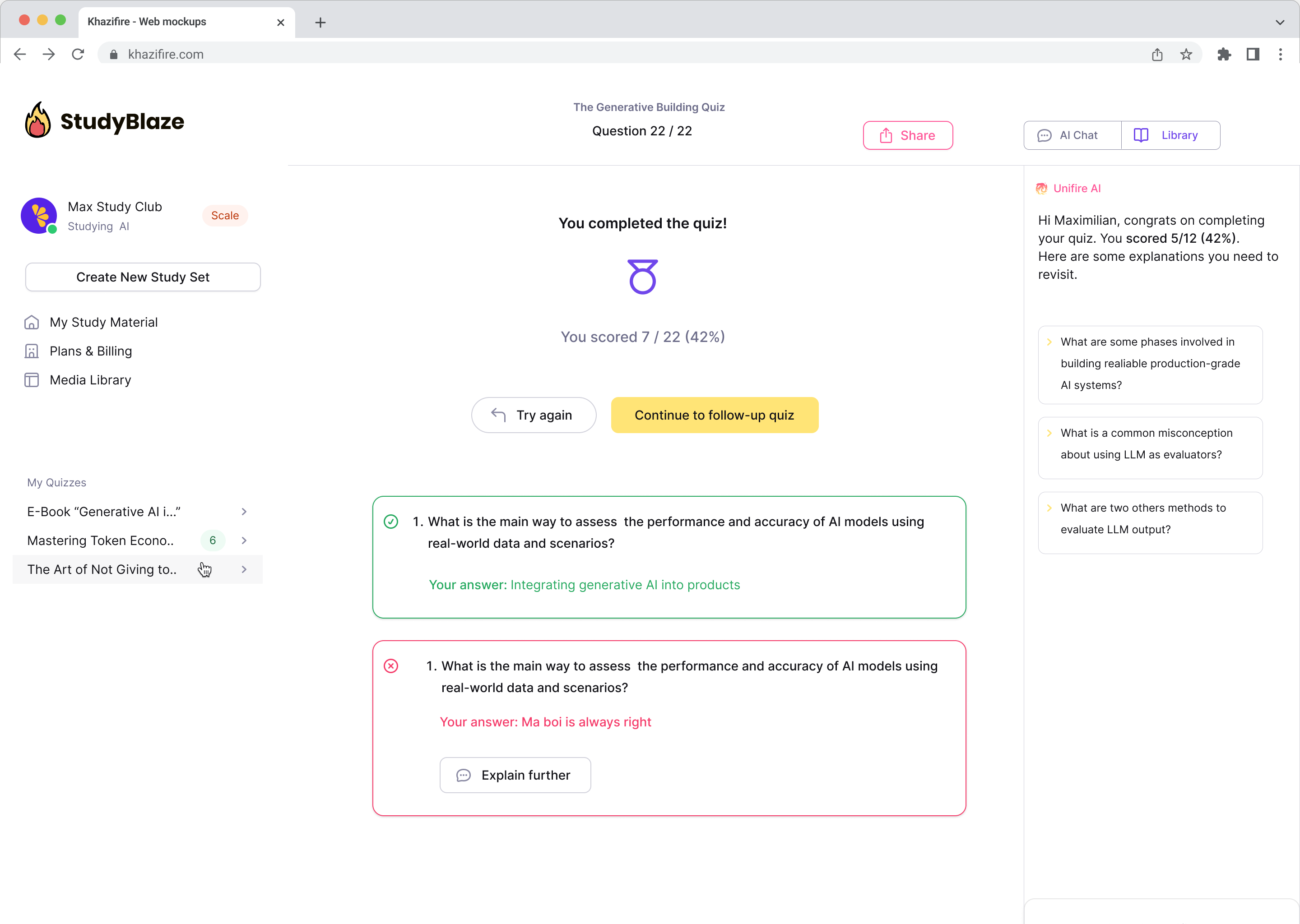
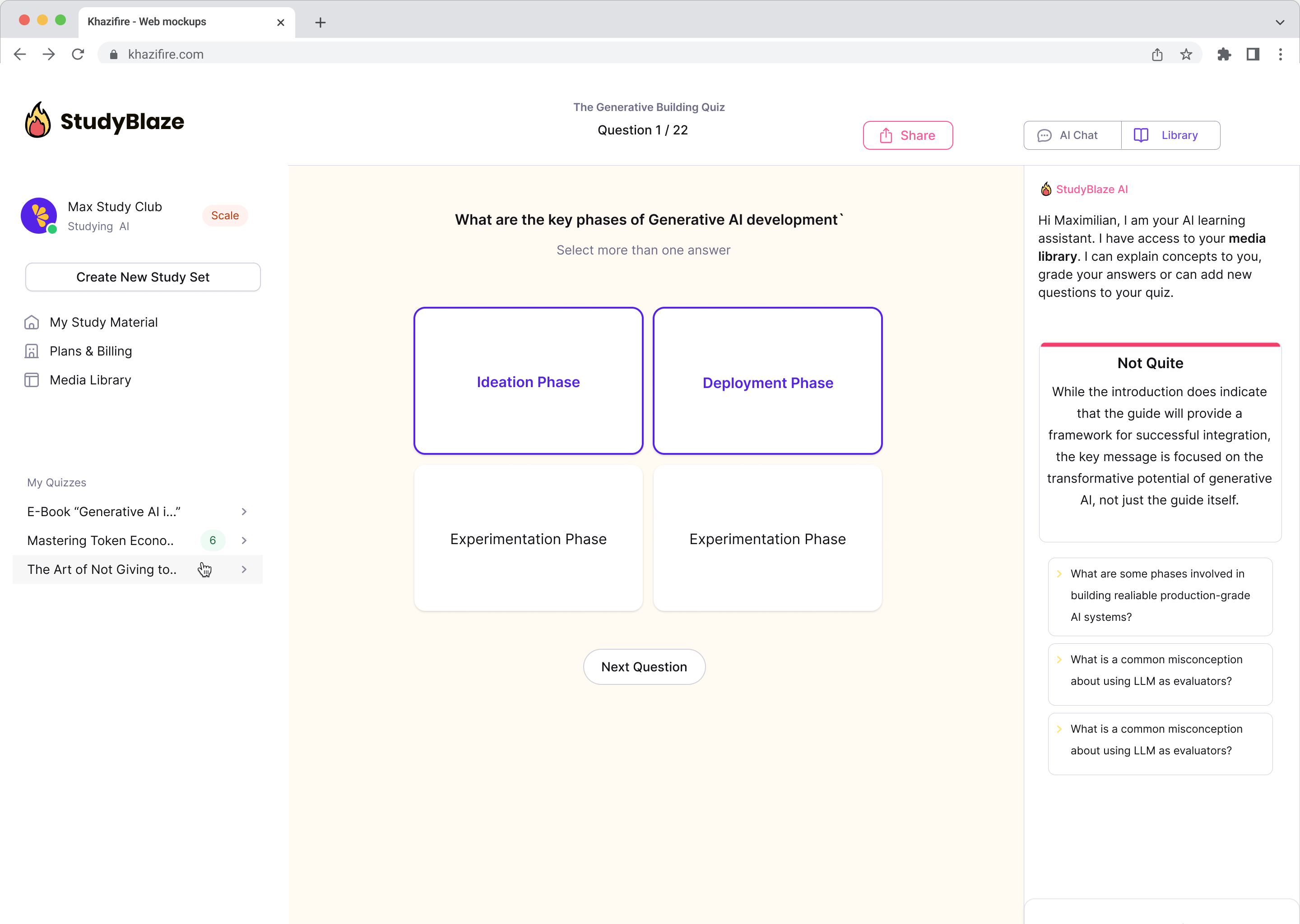
Deixe seu tutor de IA avaliar suas respostas e dizer o que você errou
Perguntas mais populares
Respondemos às perguntas mais importantes que usuários como você têm.
Atualize seus hábitos de estudo
Com o StudyBlaze, você pode melhorar imediatamente sua velocidade de aprendizado. Em vez de ler materiais chatos repetidamente, teste seu conhecimento mais rápido, sem horas de criação manual de flashcards e resumos.
