Generator AI dla
Quizy, fiszki
& Jeszcze
Przekształć nudne treści do nauki w interaktywne arkusze robocze, quizy, fiszki i pytania ćwiczeniowe obsługiwane przez AI za pomocą jednego kliknięcia. Prześlij pliki PDF, dokumenty, pliki audio i wideo już dziś, aby rozpocząć.
Zatrzymaj pracę ręczną
Większość uczniów marnuje czas na nieefektywne metody nauki
Zamiast poświęcać wiele godzin na ponowne czytanie długich dokumentów lub ręczne tworzenie fiszek i streszczeń, pomożemy Ci pominąć te kroki.
Przestań tonąć w informacjach i pozwól naszej sztucznej inteligencji odfiltrować to, co naprawdę ważne. Szybko zacznij testować siebie i doskonal się szybciej.
Bardzo niewiele osób może sobie pozwolić na osobistego korepetytora. StudyBlaze zmienia to na zawsze. Interaktywna nauka sprawia, że postępy są 10 razy szybsze.
Ręczne tworzenie materiałów do nauki to czas, który możesz poświęcić na szkolenie i testowanie siebie. Zmniejsz stres, całkowicie eliminując pracę ręczną.
Tutor AI dostępny 24/7
Uzyskaj dostęp do korepetytora każdego dnia
Otrzymaj natychmiastową informację zwrotną na temat swoich odpowiedzi
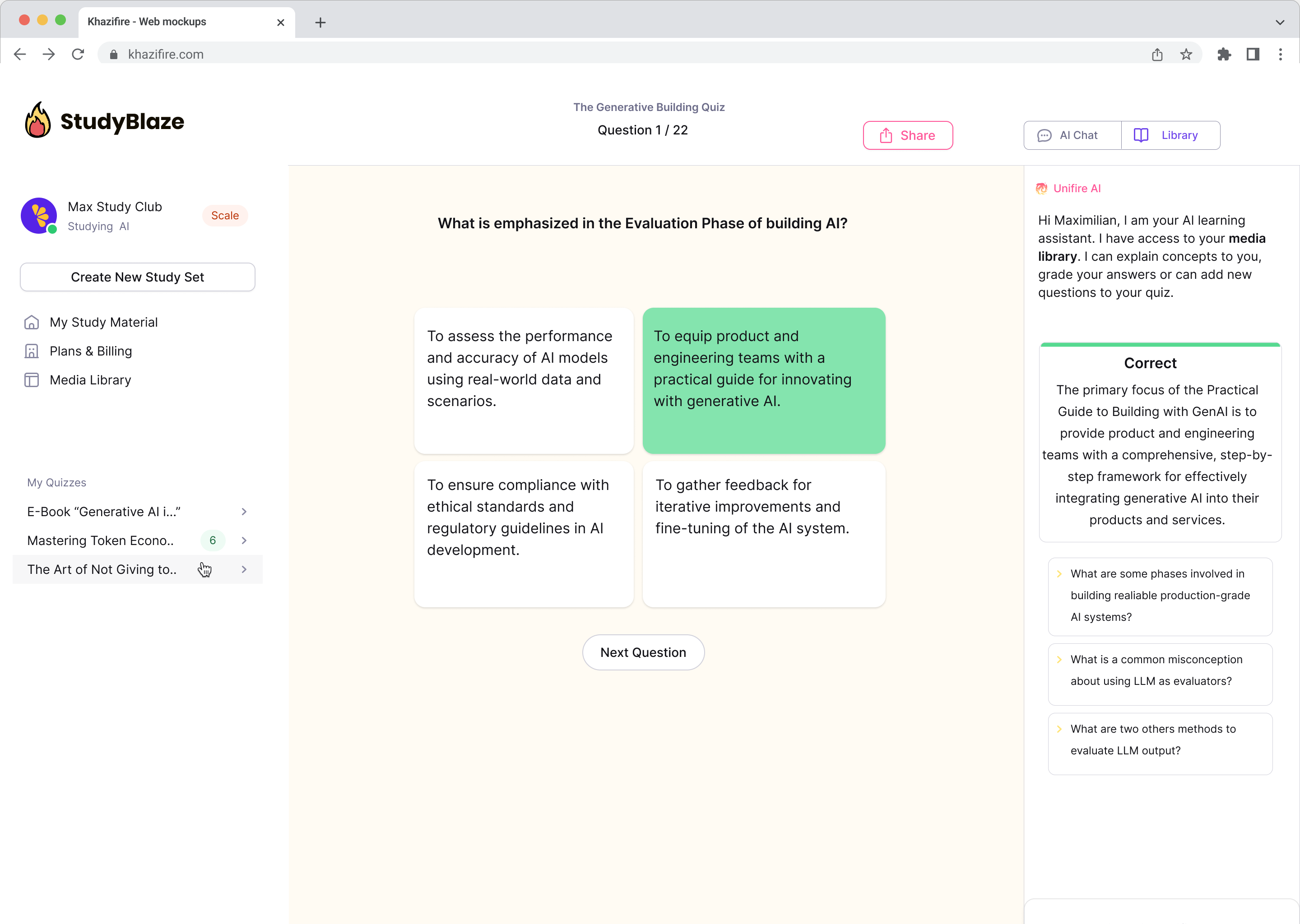
Rozmawiaj na czacie ze swoimi dokumentami i szybciej zrozumiesz złożone tematy
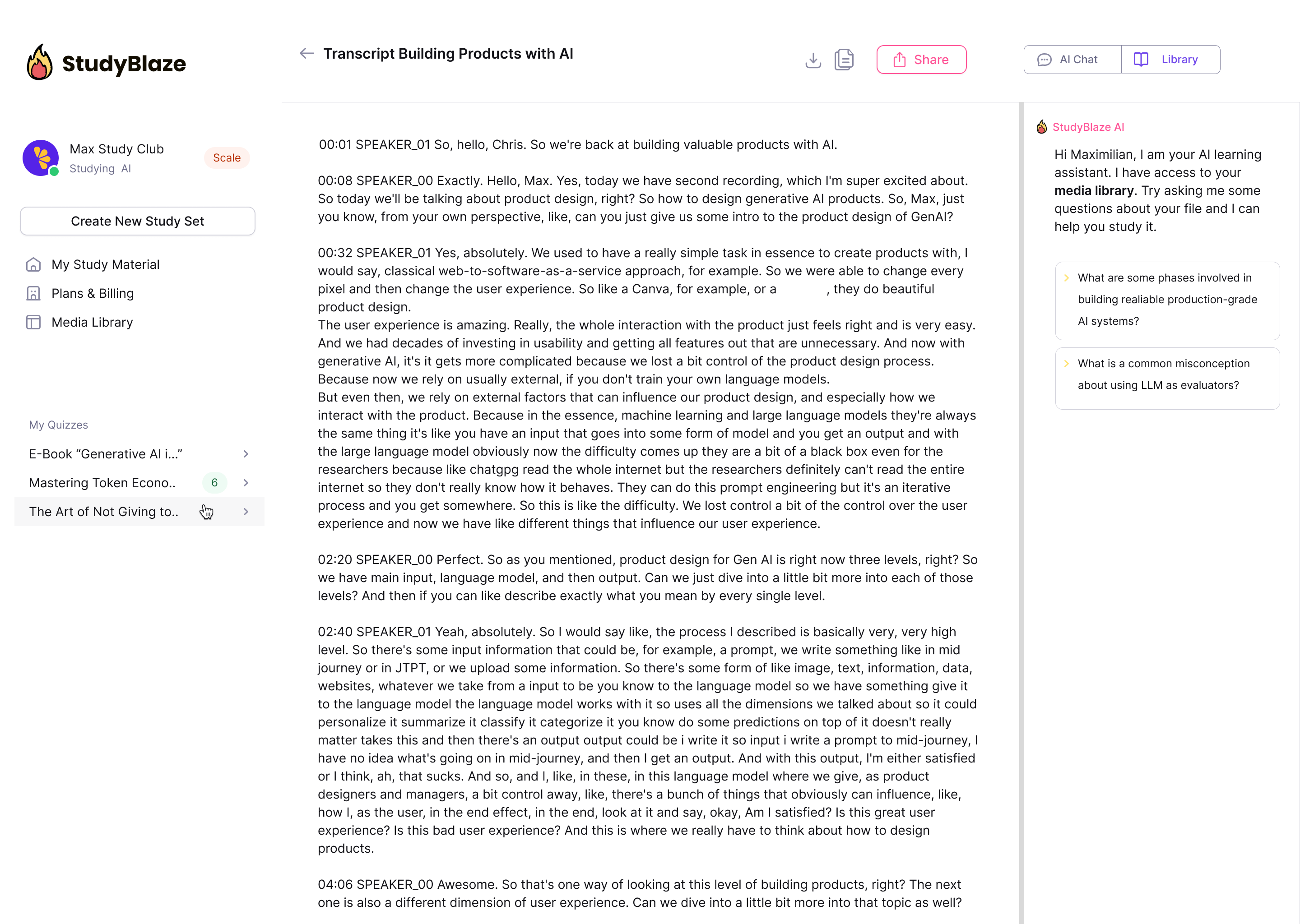
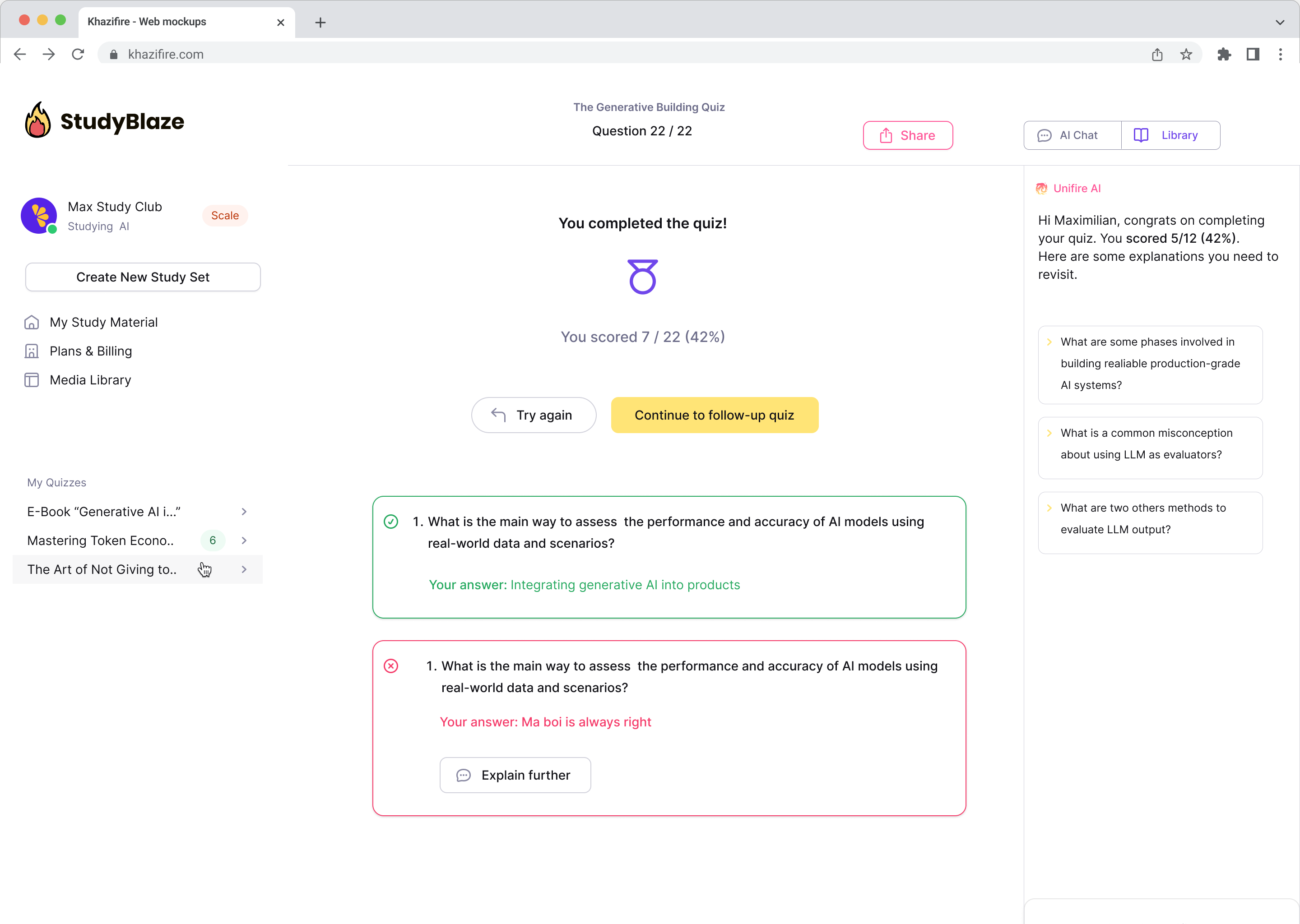
Pozwól swojemu nauczycielowi AI ocenić Twoje odpowiedzi i powiedzieć Ci, czego nie zauważyłeś
Najpopularniejsze pytania
Odpowiadamy na najważniejsze pytania użytkowników takich jak Ty.
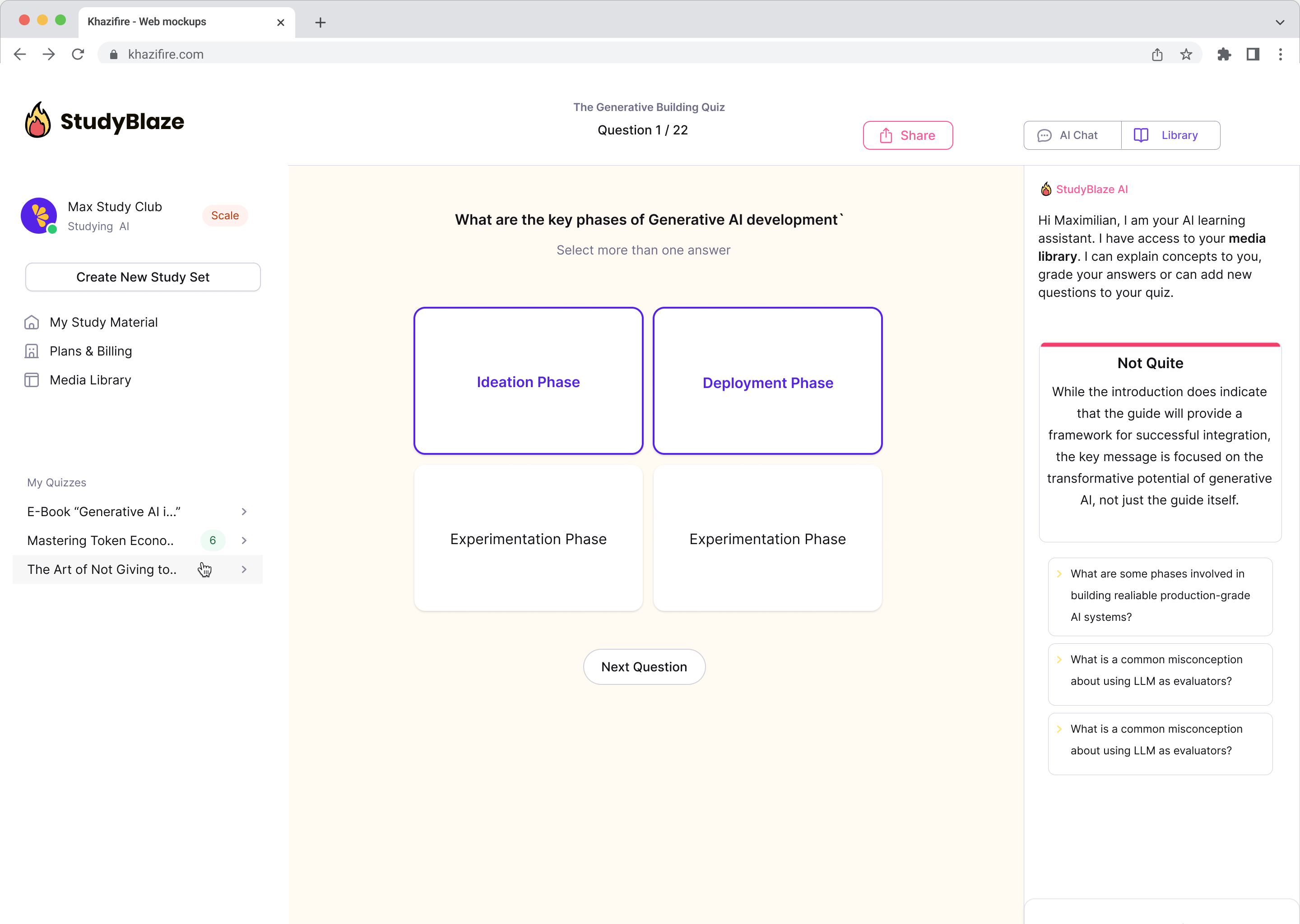
Ulepsz swoje nawyki związane z nauką
Dzięki StudyBlaze możesz natychmiast zwiększyć szybkość uczenia się. Zamiast czytać nudne materiały w kółko, przetestuj swoją wiedzę szybciej, bez godzin ręcznego tworzenia fiszek i podsumowań.
