AI Generator for
Quiz, Flashcards
& Mer
Gjør om det kjedelige studieinnholdet ditt til interaktive AI-drevne regneark, quizer, flashcards og øvingsspørsmål med et klikk på en knapp. Last opp PDF-er, dokumenter, lyd og video i dag for å komme i gang.
Stopp det manuelle arbeidet
De fleste elever kaster bort tid på ineffektive læringsmetoder
I stedet for å lese de lange dokumentene dine på nytt eller manuelt lage kort og sammendrag i timevis, hjelper vi deg med å hoppe over disse trinnene.
Slutt å drukne i informasjon og la vår AI filtrere ut det som virkelig er viktig. Begynn raskt å teste deg selv og forbedre deg raskere.
Svært få mennesker har råd til en personlig veileder. StudyBlaze endrer dette for alltid. Interaktiv læring gjør fremgangen din 10 ganger raskere.
Manuell å lage studiemateriell er tid du kan bruke på å trene og teste deg selv. Reduser stress ved å eliminere manuelt arbeid helt.
En AI-veileder tilgjengelig 24/7
Ha tilgang til en veileder hver dag
Få umiddelbar tilbakemelding på svarene dine
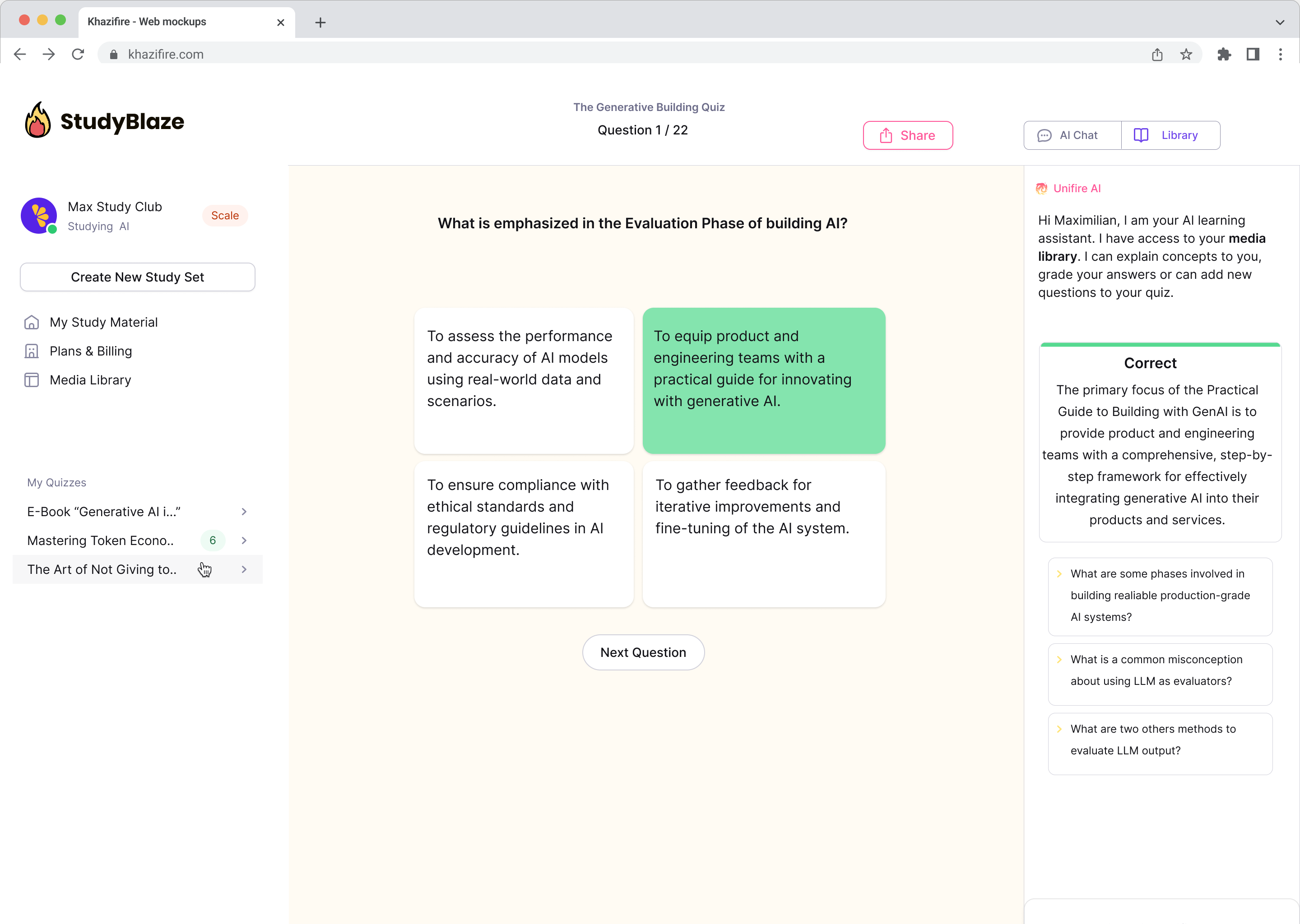
Chat med dokumentene dine og forstå komplekse emner raskere
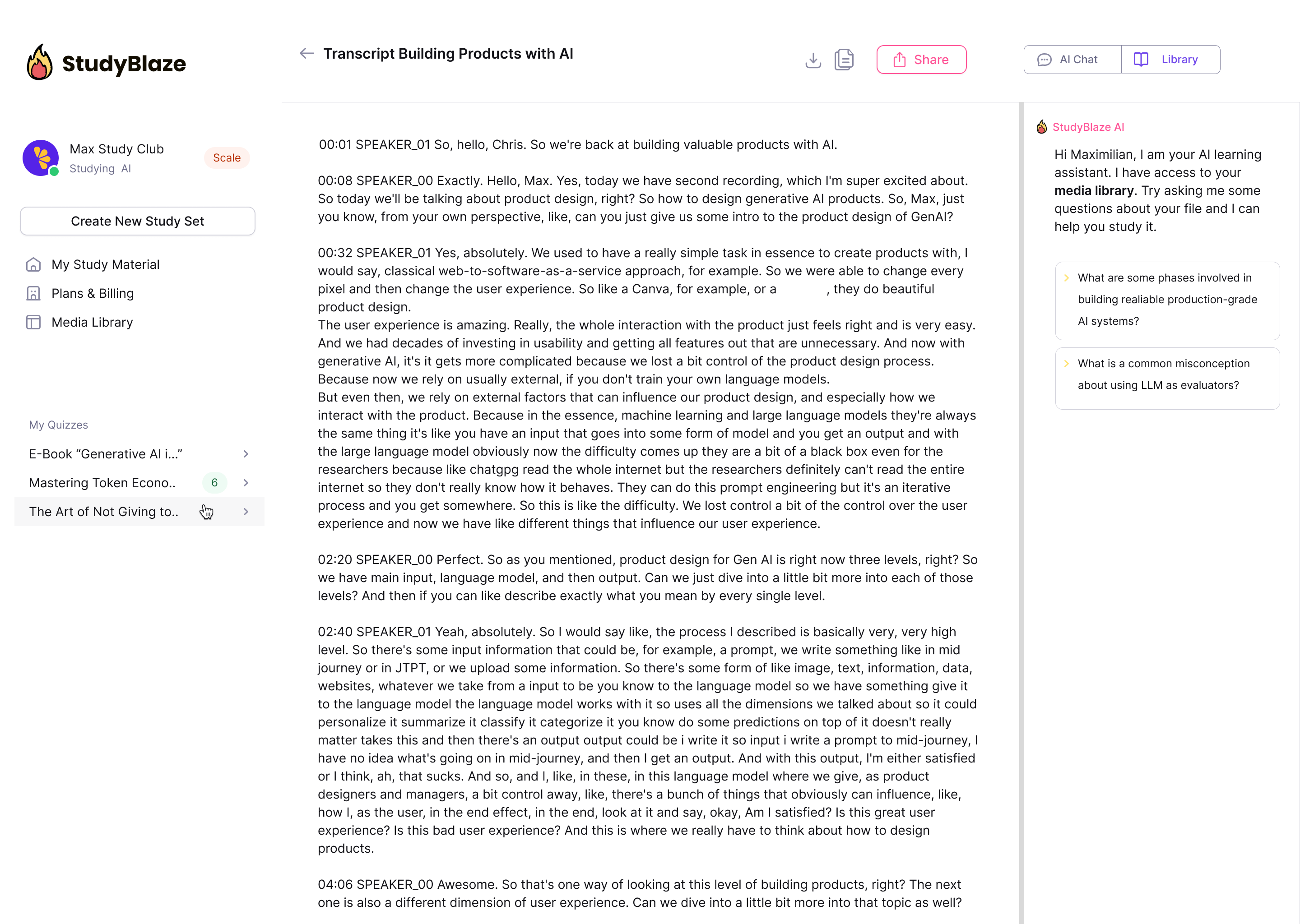
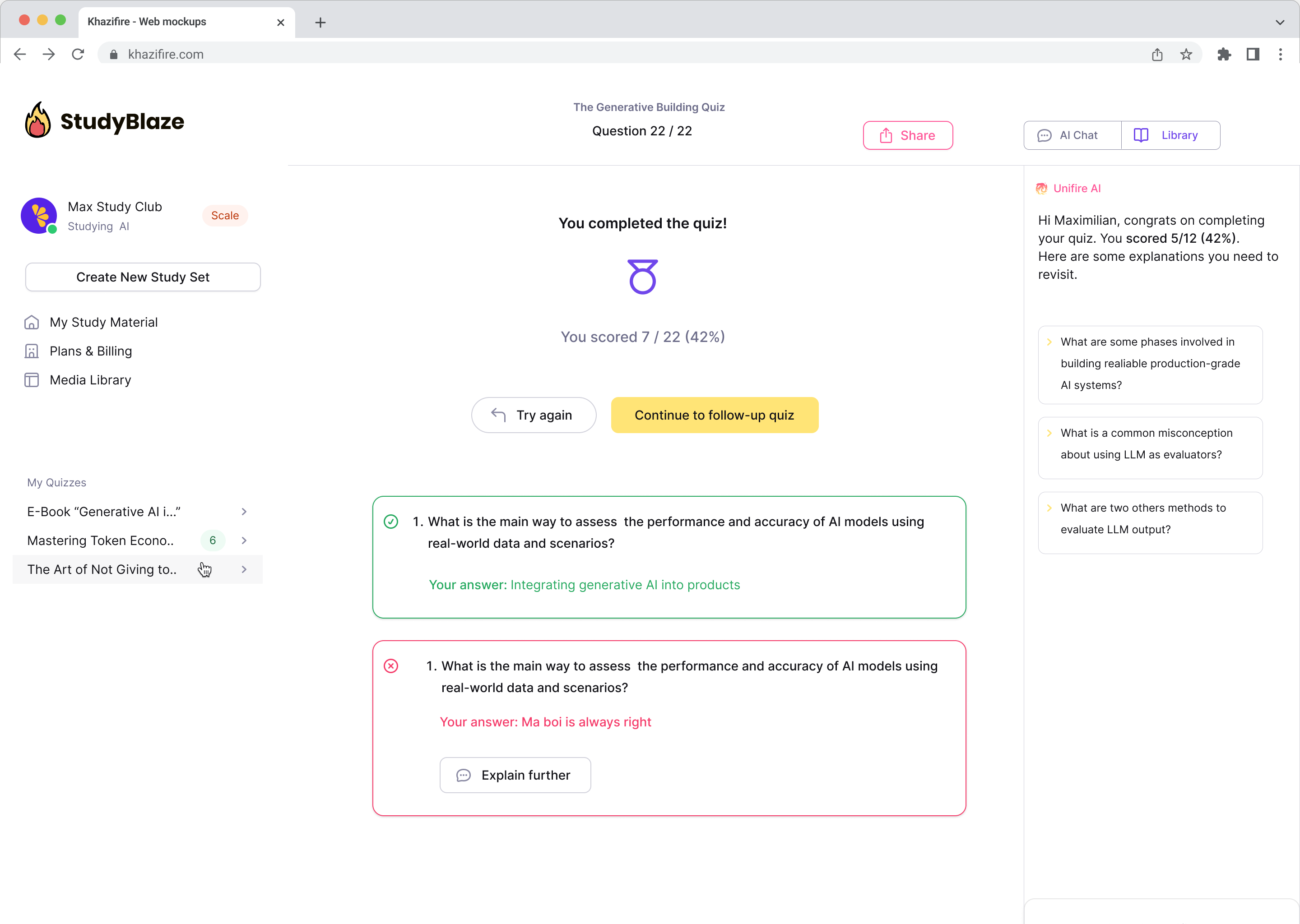
La AI-veilederen din vurdere svarene dine og fortelle deg hva du gikk glipp av
Mest populære spørsmål
Vi svarer på de viktigste spørsmålene brukere som deg har.
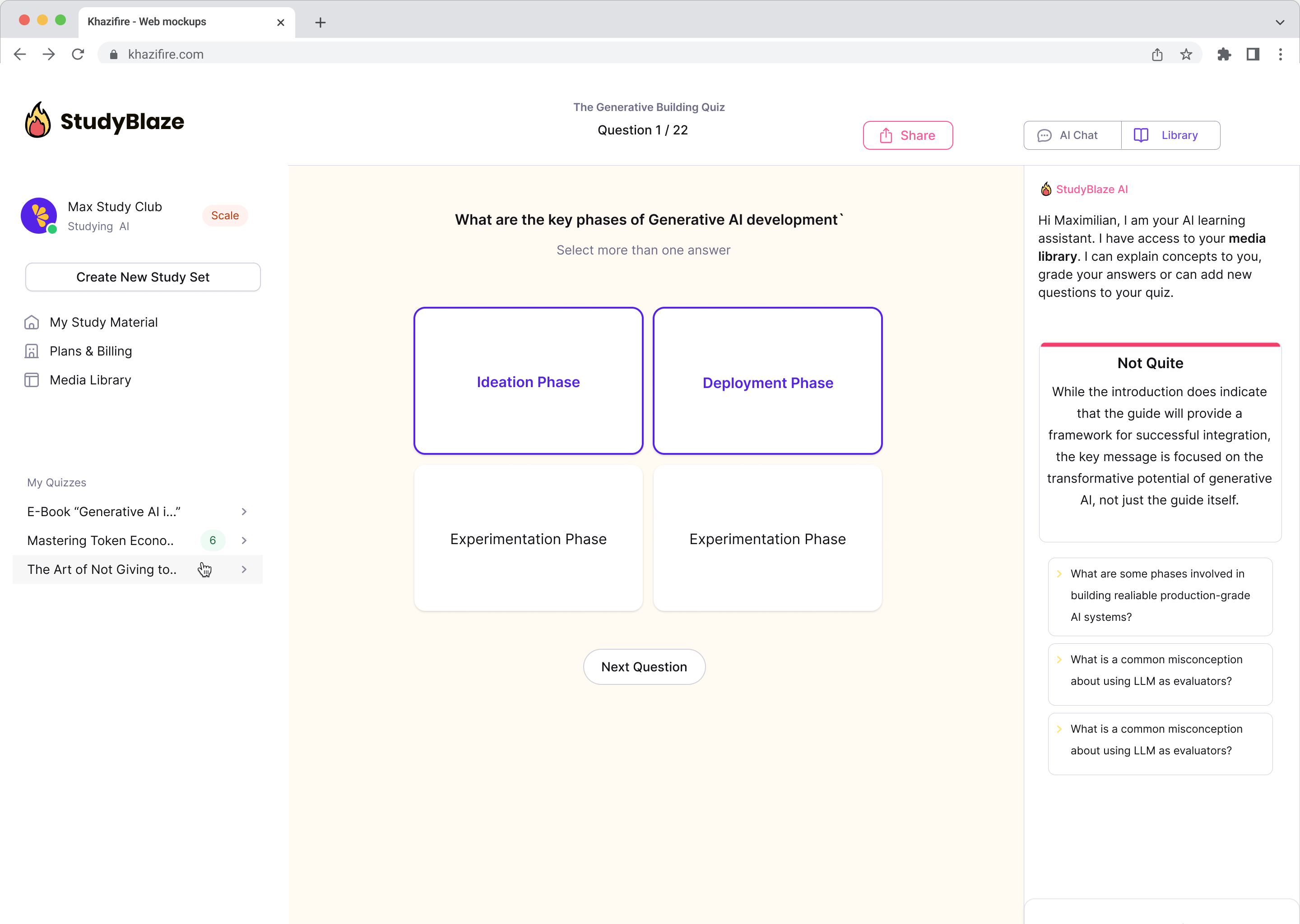
Oppgrader studievanene dine
Med StudyBlaze kan du umiddelbart forbedre læringshastigheten din. I stedet for å lese kjedelig materiale om og om igjen, kan du teste kunnskapen din raskere uten timer med manuell flashkort og oppsummering.
