AI-generator voor
Quizzen, Flashcards
& Meer
Transformeer uw saaie studie-inhoud in interactieve AI-aangedreven werkbladen, quizzen, flashcards en oefenvragen met een klik op de knop. Upload vandaag nog PDF's, documenten, audio en video om te beginnen.
Stop met het handmatige werk
De meeste studenten verspillen tijd aan inefficiënte leermethoden
In plaats van urenlang uw lange documenten opnieuw te lezen of handmatig flashcards en samenvattingen te maken, helpen wij u deze stappen over te slaan.
Stop met verdrinken in informatie en laat onze AI eruit filteren wat echt belangrijk is. Begin snel met testen en verbeter jezelf sneller.
Heel weinig mensen kunnen zich een persoonlijke tutor veroorloven. StudyBlaze verandert dit voorgoed. Interactief leren zorgt ervoor dat je 10x sneller vooruitgang boekt.
Handmatig studiemateriaal maken is tijd die je zou kunnen besteden aan het trainen en testen van jezelf. Verminder stress door handmatig werk volledig te elimineren.
Een AI-tutor die 24/7 beschikbaar is
Heb elke dag toegang tot een tutor
Ontvang direct feedback op uw antwoorden
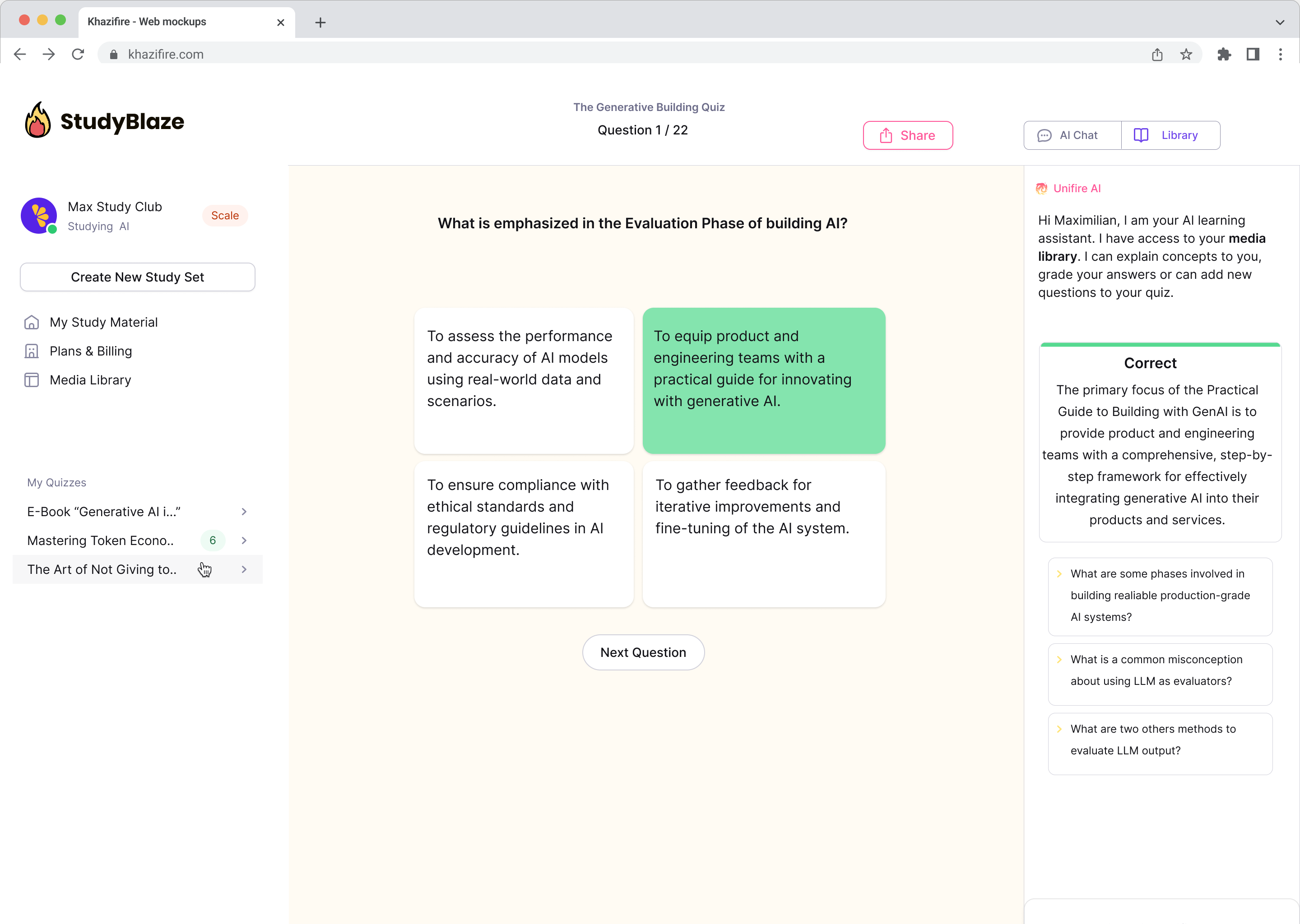
Chat met uw documenten en begrijp complexe onderwerpen sneller
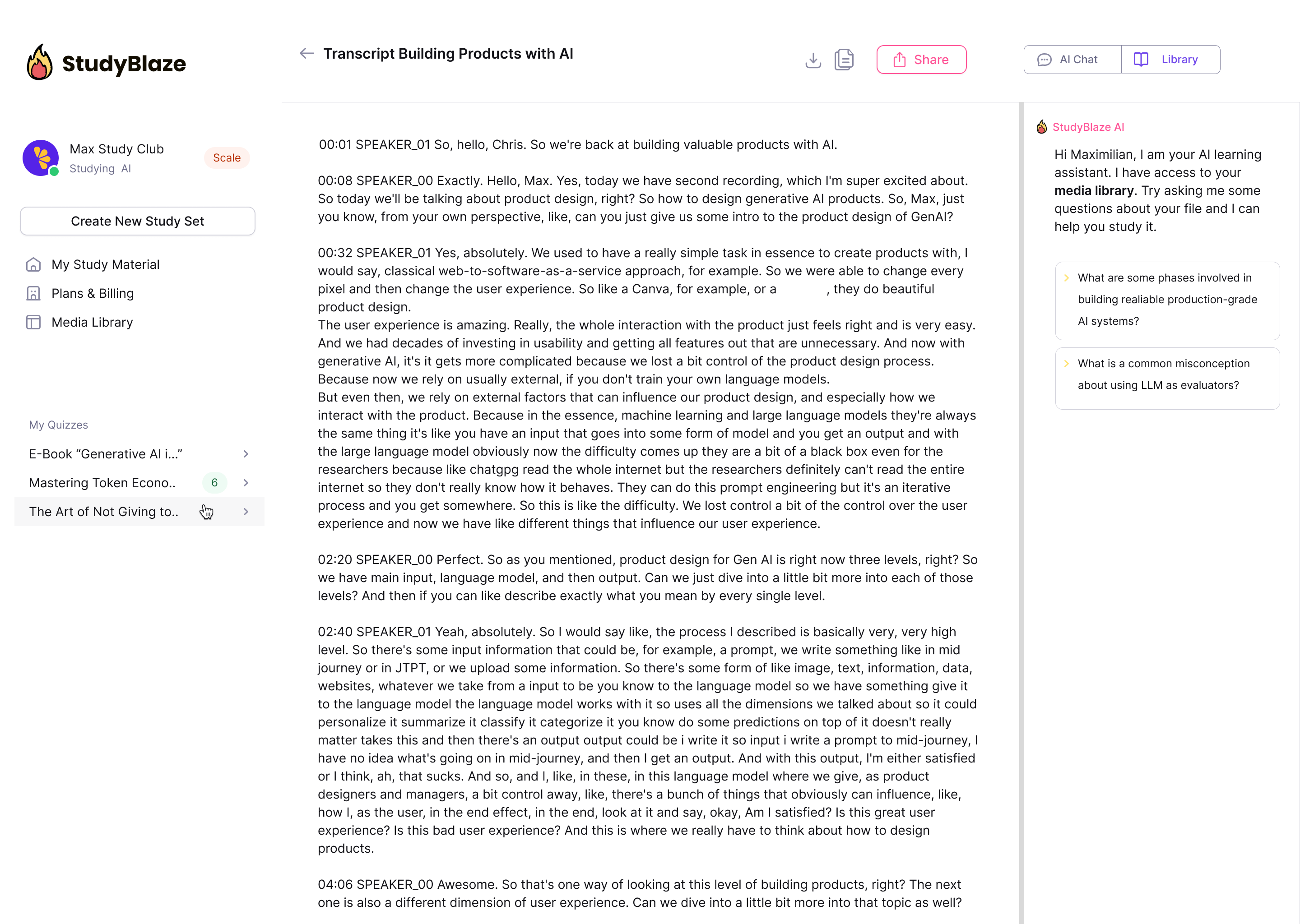
Laat je AI-tutor je antwoorden beoordelen en je vertellen wat je gemist hebt
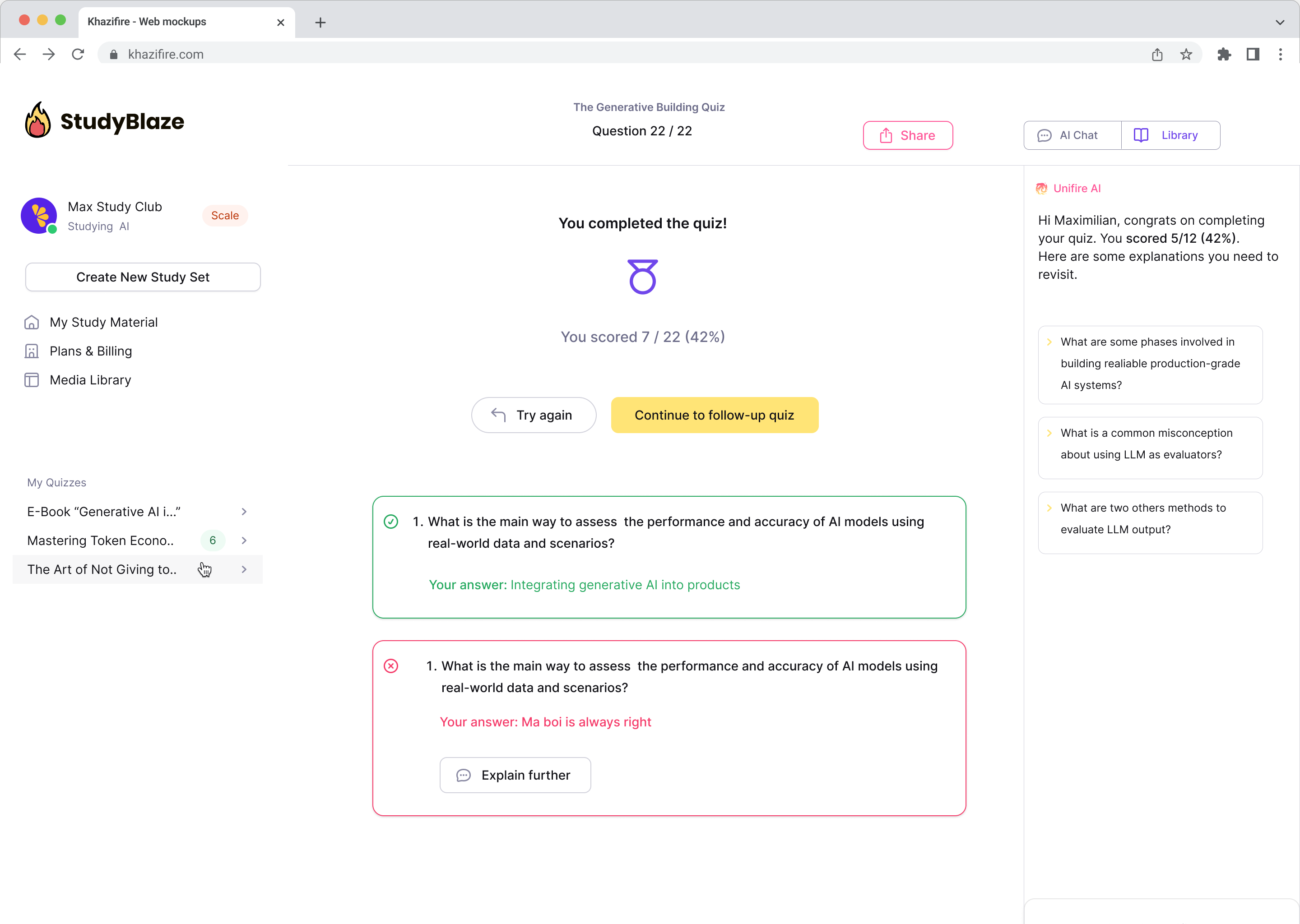
Meest populaire vragen
Wij beantwoorden de belangrijkste vragen van gebruikers zoals jij.
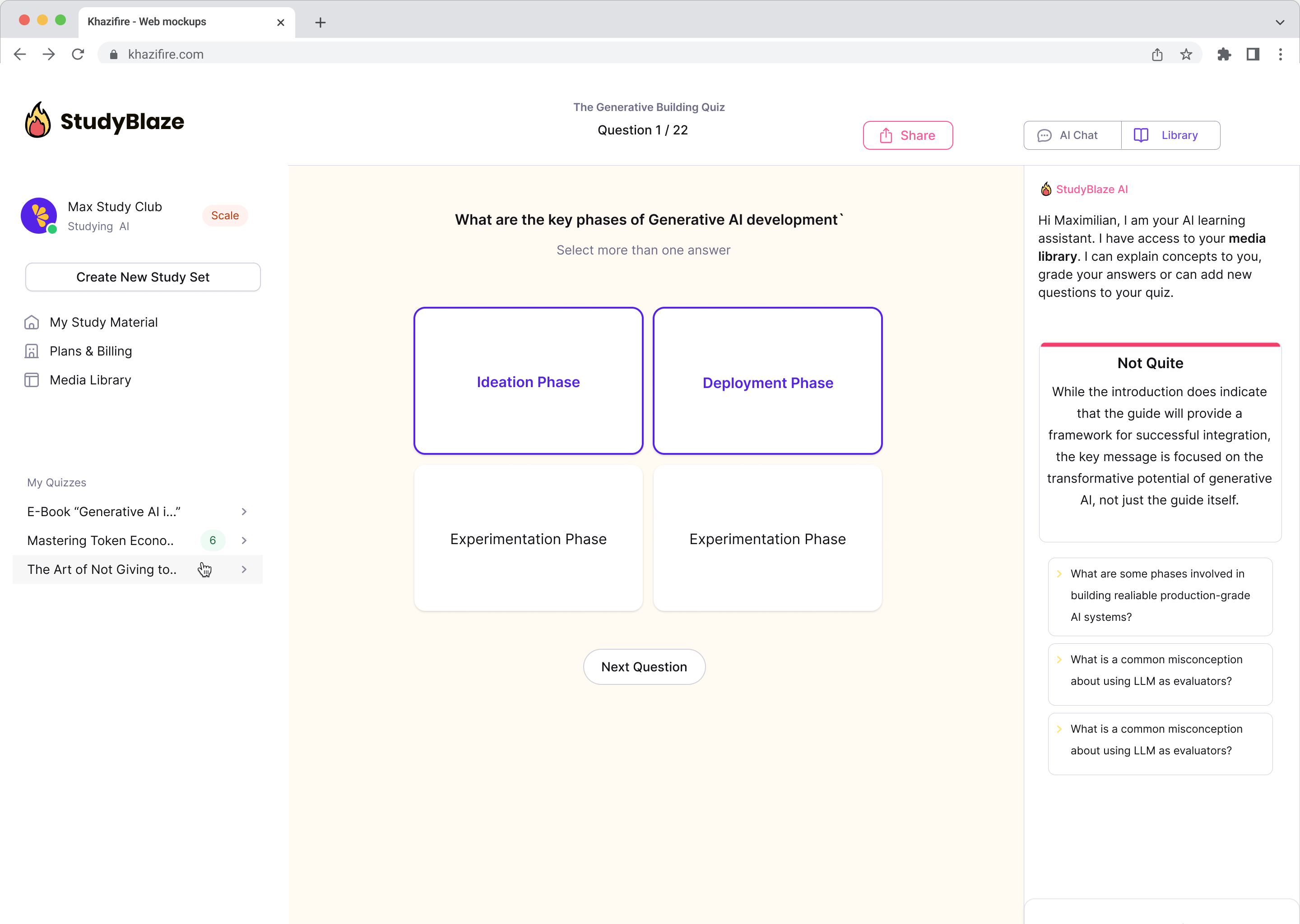
Verbeter uw studiegewoonten
Met StudyBlaze kunt u direct uw leersnelheid verbeteren. In plaats van saaie materialen keer op keer te lezen, kunt u uw kennis sneller testen zonder urenlang handmatig flashcards en samenvattingen te maken.
