AI ģenerators priekš
Viktorīnas, kartītes
& Vairāk
Pārveidojiet savu garlaicīgo mācību saturu interaktīvās ar AI darbināmās darblapās, viktorīnās, zibatmiņas kartēs un praktiskos jautājumos, noklikšķinot uz pogas. Lai sāktu darbu, augšupielādējiet PDF failus, dokumentus, audio un video jau šodien.
Pārtrauciet manuālo darbu
Lielākā daļa skolēnu tērē laiku neefektīvām mācību metodēm
Tā vietā, lai atkārtoti lasītu garos dokumentus vai stundām ilgi manuāli veidotu kartītes un kopsavilkumus, mēs palīdzam jums izlaist šīs darbības.
Pārtrauciet slīkt informācijā un ļaujiet mūsu AI filtrēt to, kas patiešām ir svarīgs. Ātri sāciet pārbaudīt sevi un pilnveidojieties ātrāk.
Ļoti maz cilvēku var atļauties personīgo pasniedzēju. StudyBlaze to maina uz visiem laikiem. Interaktīvā mācīšanās padara jūsu progresu 10 reizes ātrāku.
Mācību materiālu manuāla izveide ir laiks, ko varat pavadīt apmācībā un sevis pārbaudē. Samaziniet stresu, pilnībā izslēdzot roku darbu.
AI pasniedzējs ir pieejams visu diennakti
Katru dienu varat sazināties ar pasniedzēju
Saņemiet tūlītēju atgriezenisko saiti par savām atbildēm
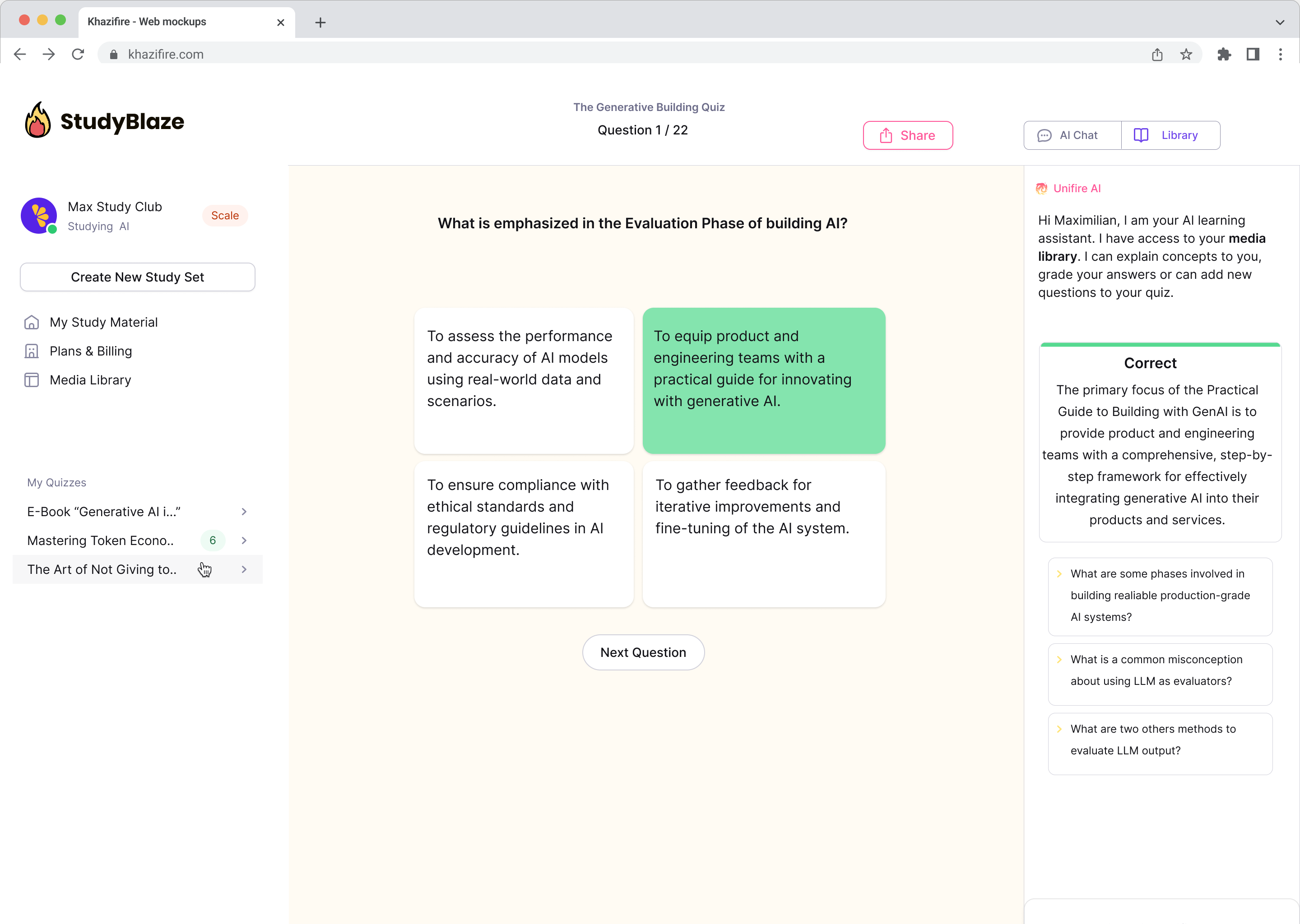
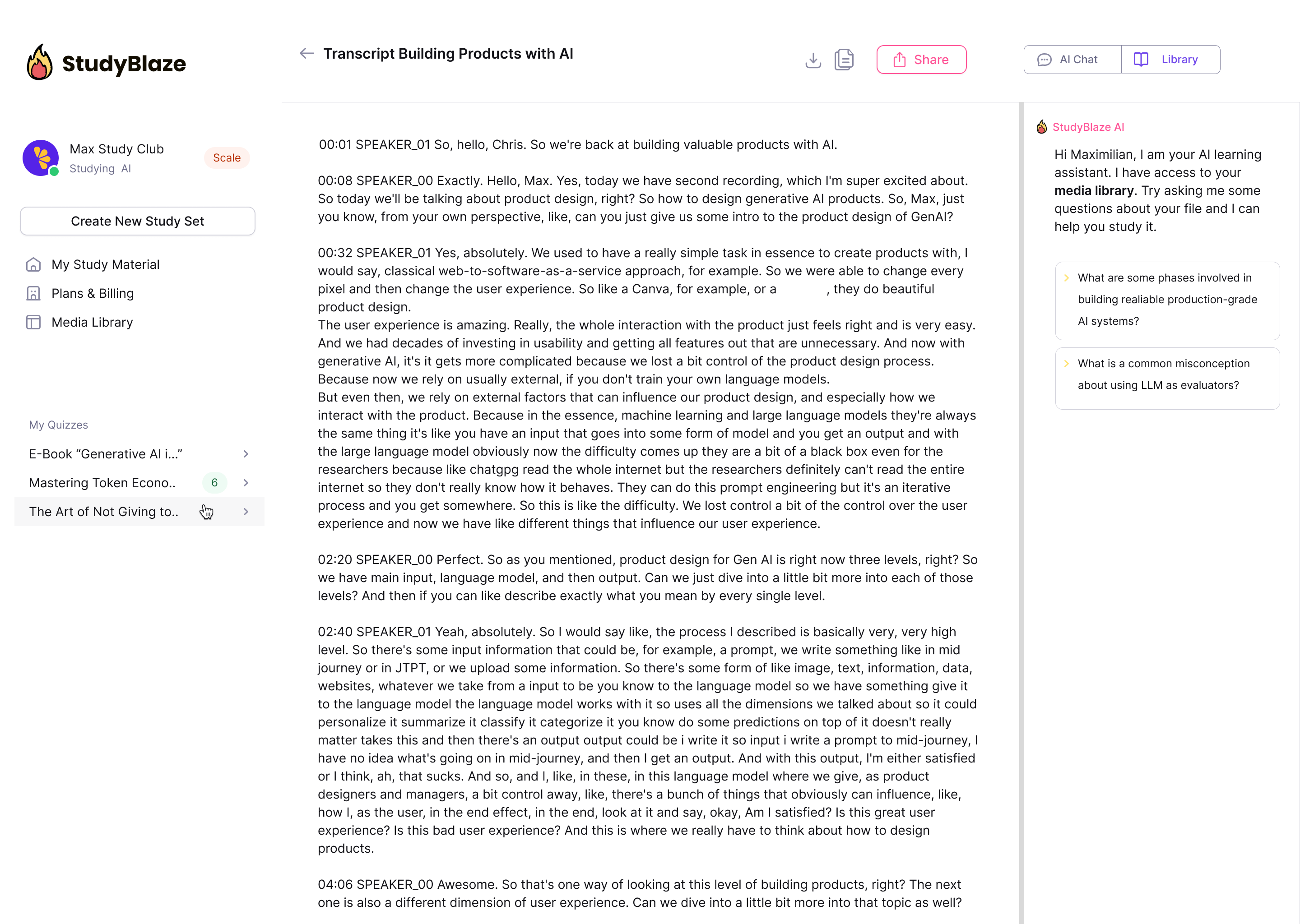
Tērzējiet ar saviem dokumentiem un ātrāk izprotiet sarežģītas tēmas
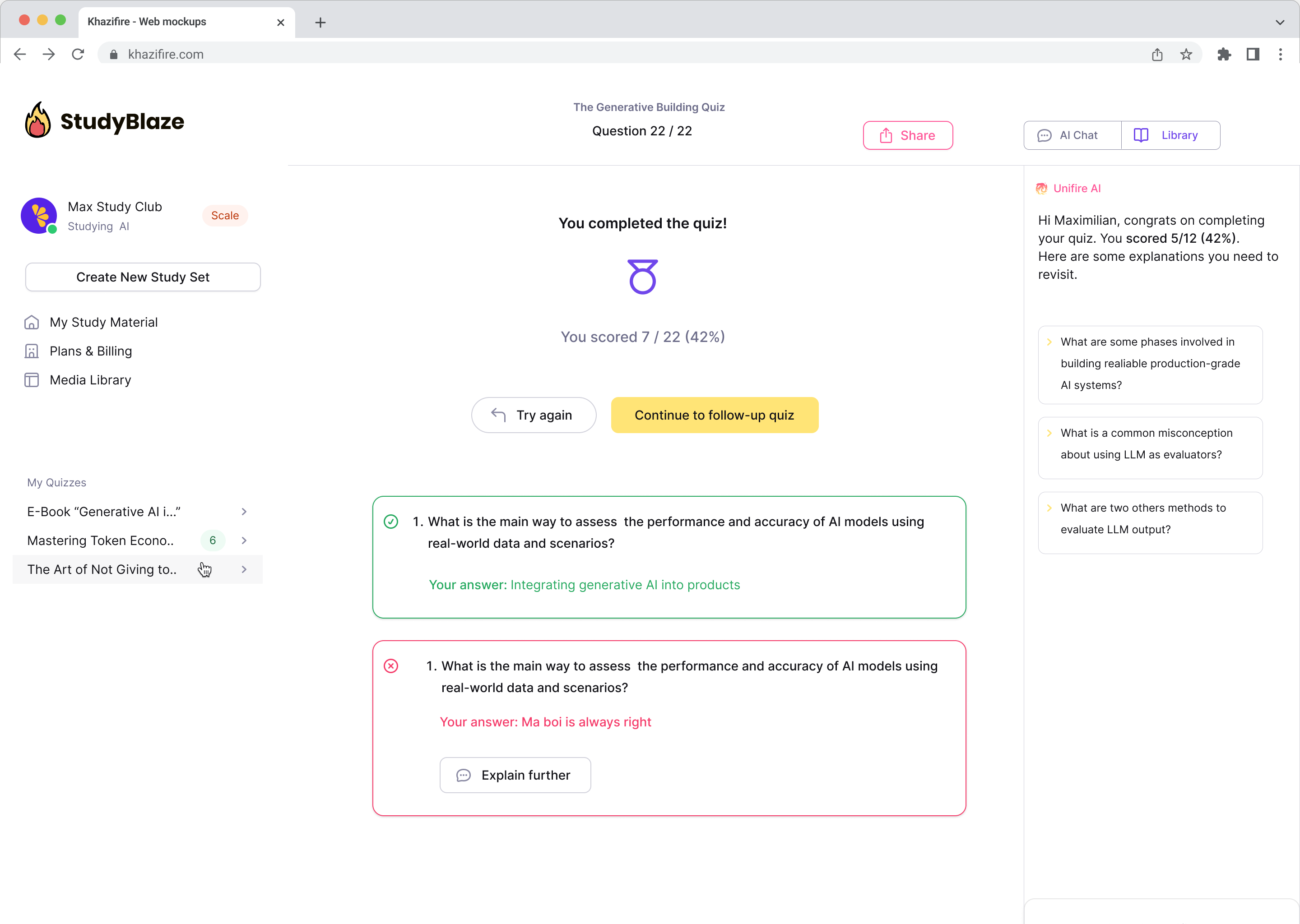
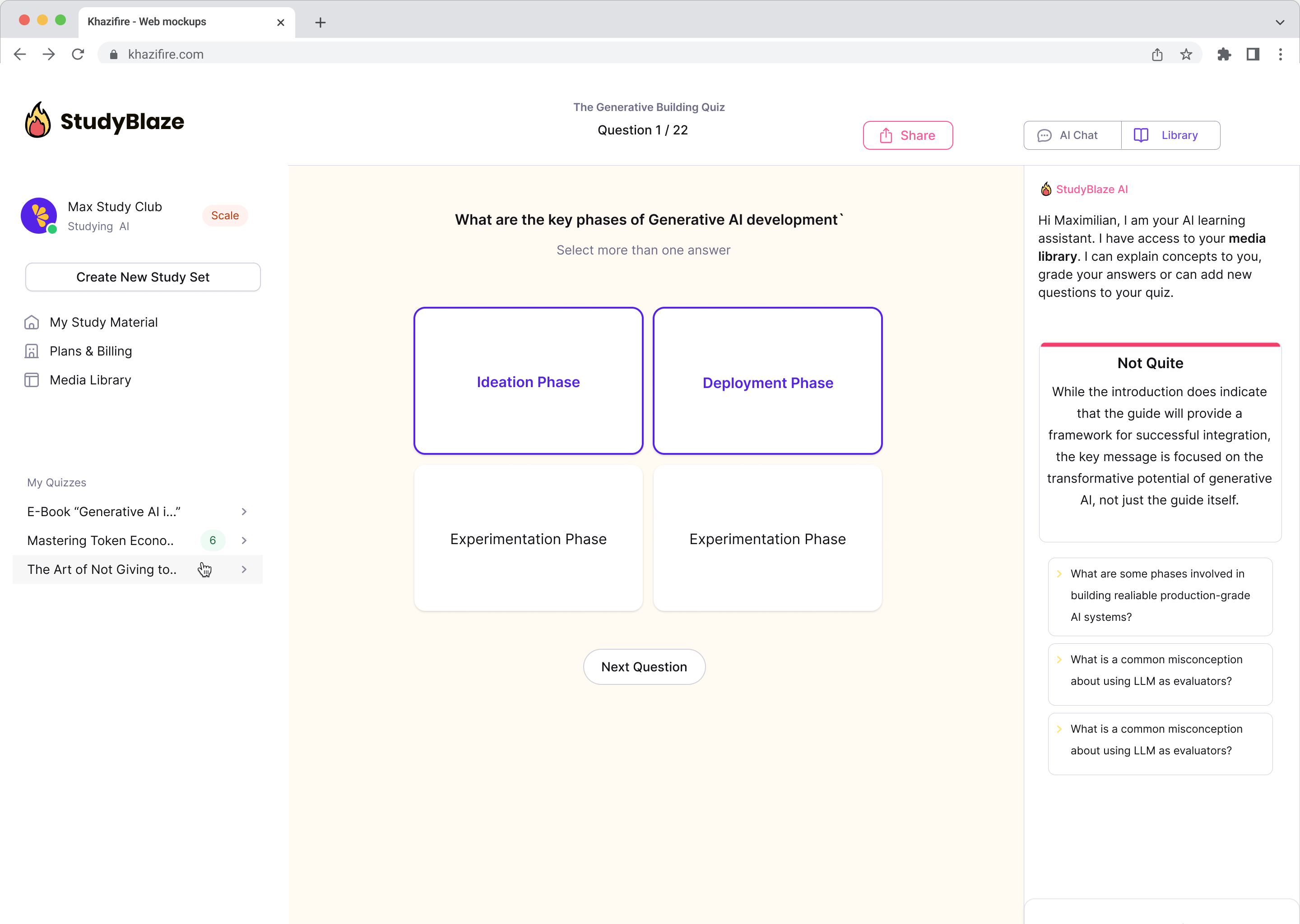
Ļaujiet savam AI skolotājam novērtēt jūsu atbildes un pastāstīt, ko palaidāt garām
Populārākie jautājumi
Mēs atbildam uz svarīgākajiem jautājumiem, kas uzdoti tādiem lietotājiem kā jūs.
Uzlabojiet savus studiju paradumus
Ar StudyBlaze jūs varat nekavējoties uzlabot mācīšanās ātrumu. Tā vietā, lai atkal un atkal lasītu garlaicīgus materiālus, pārbaudiet savas zināšanas ātrāk, bez stundām ilgas manuālas kartītes un kopsavilkuma izveides.
