AI generatorius, skirtas
Viktorinos, kortelės
& Daugiau
Vienu mygtuko paspaudimu paverskite savo nuobodų studijų turinį į interaktyvius dirbtinio intelekto darbalapius, viktorinas, korteles ir praktinius klausimus. Norėdami pradėti, įkelkite PDF, dokumentus, garso ir vaizdo įrašus šiandien.
Nutraukite rankinį darbą
Dauguma studentų švaisto laiką neefektyviems mokymosi metodams
Užuot iš naujo skaitę ilgus dokumentus ar neautomatiškai kūrę korteles ir santraukas valandų valandas, padėsime praleisti šiuos veiksmus.
Nustokite skęsti informacijoje ir leiskite mūsų AI filtruoti tai, kas tikrai svarbu. Greitai pradėkite išbandyti save ir greičiau tobulėkite.
Labai mažai žmonių gali sau leisti asmeninį mokytoją. StudyBlaze tai keičia visam laikui. Interaktyvus mokymasis padidina jūsų progresą 10 kartų greičiau.
Neautomatinis studijų medžiagos kūrimas yra laikas, kurį galite skirti mokymuisi ir išbandymui. Sumažinkite stresą visiškai atsisakydami rankų darbo.
Dirbtinio intelekto mokytojas pasiekiamas 24 valandas per parą, 7 dienas per savaitę
Turėkite prieigą prie mokytojo kiekvieną dieną
Gaukite tiesioginį atsiliepimą apie savo atsakymus
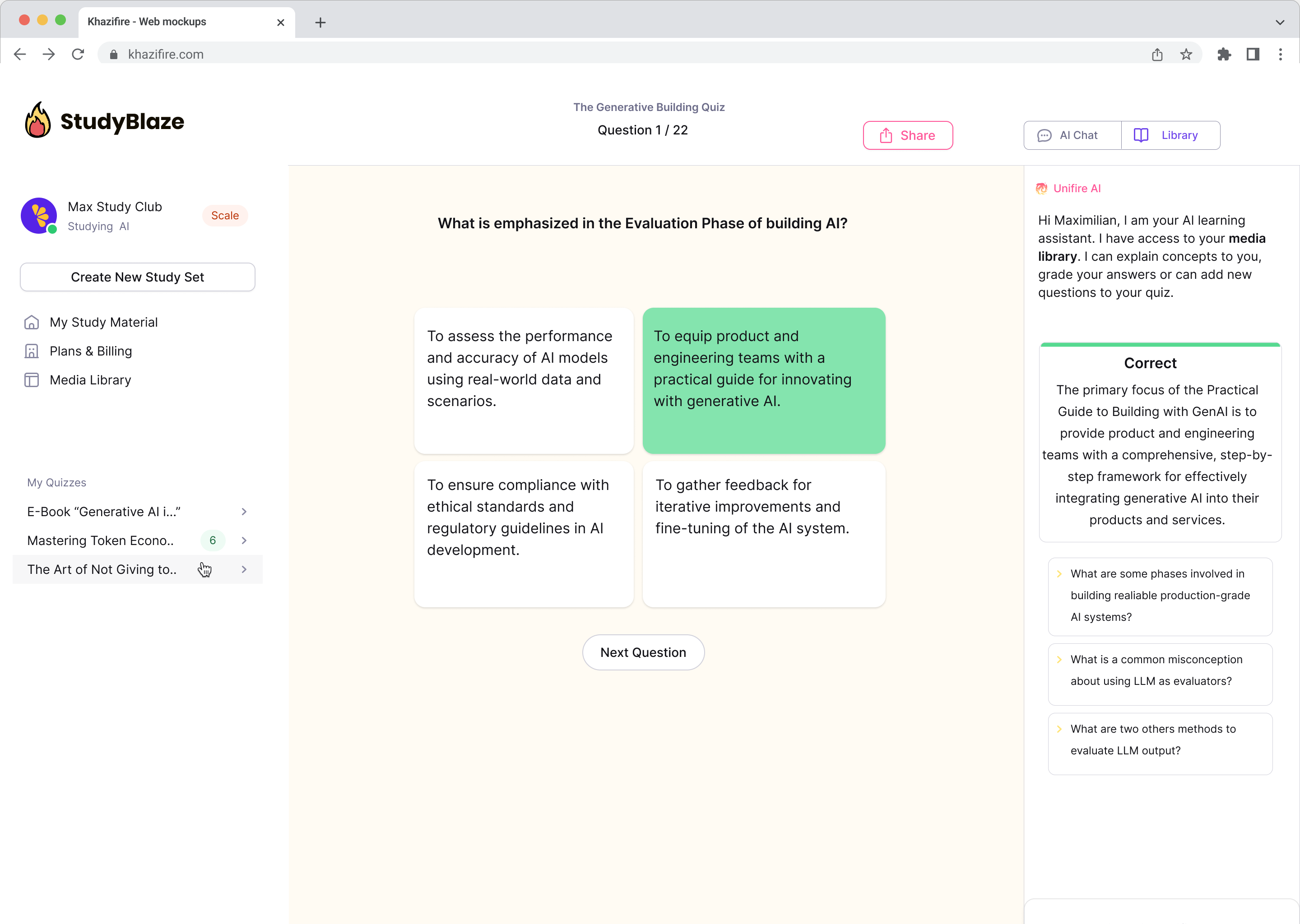
Kalbėkite su savo dokumentais ir greičiau supraskite sudėtingas temas
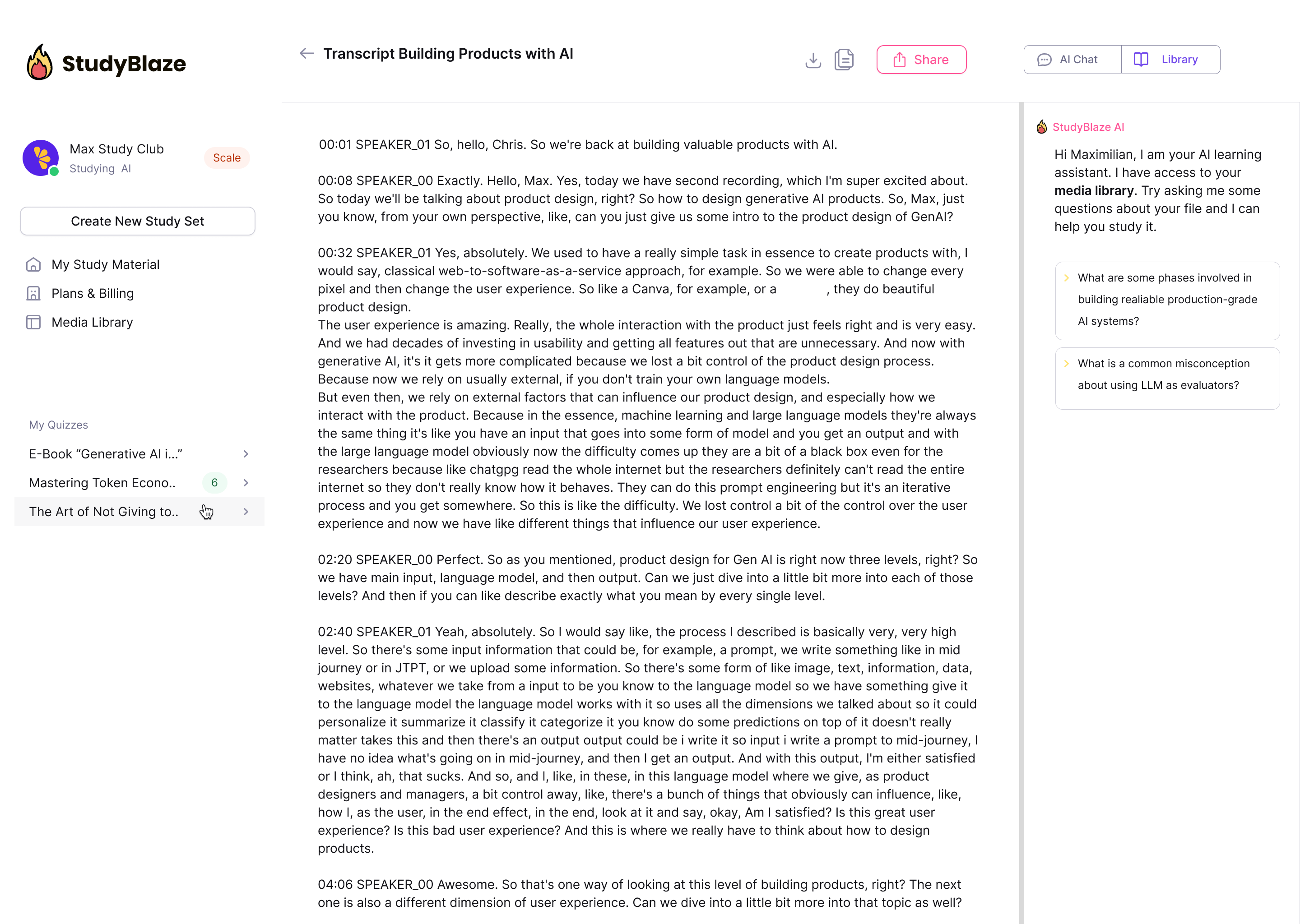
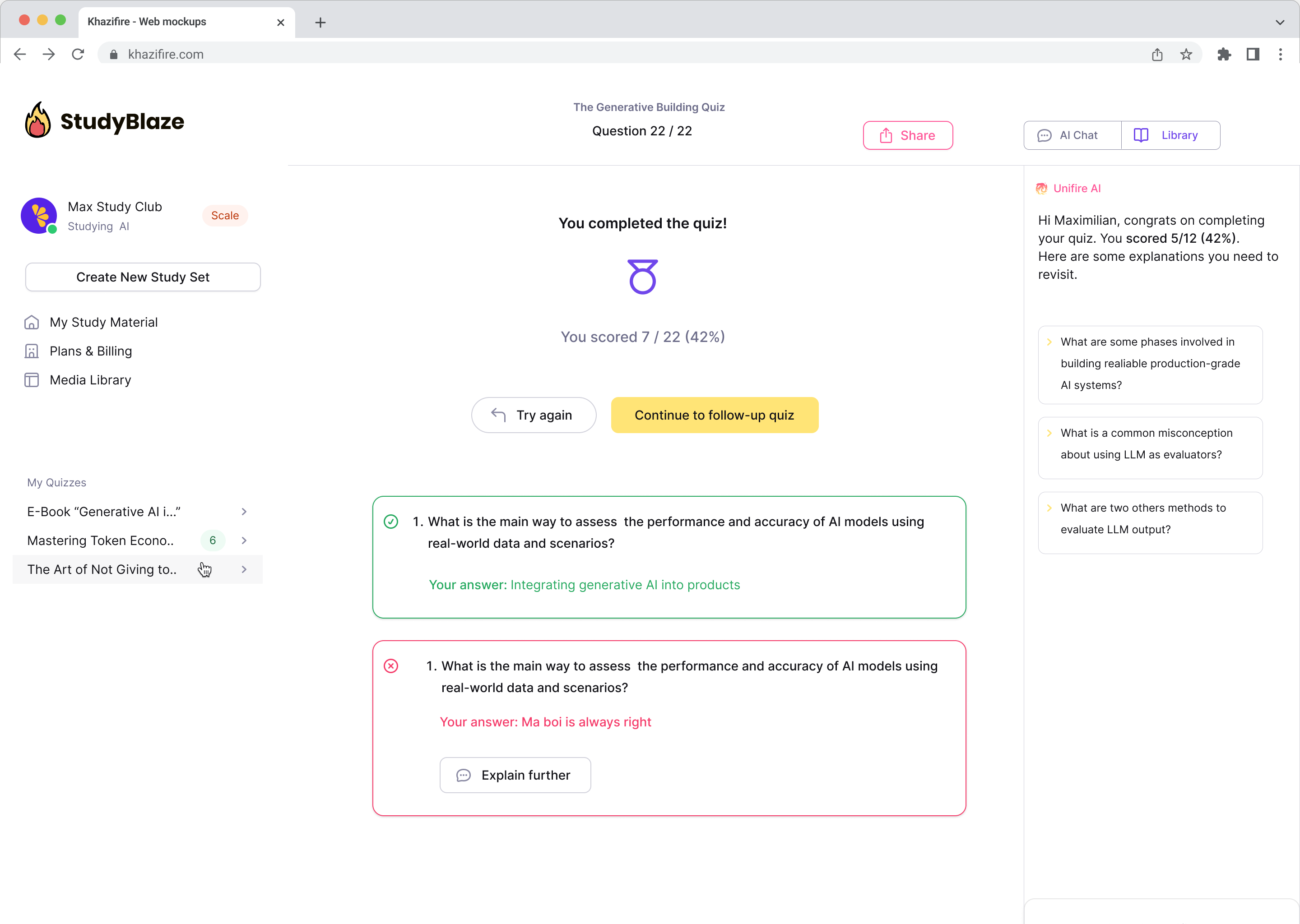
Leiskite dirbtinio intelekto mokytojui įvertinti jūsų atsakymus ir pasakyti, ką praleidote
Populiariausi klausimai
Atsakome į svarbiausius tokių vartotojų klausimus kaip jūs.
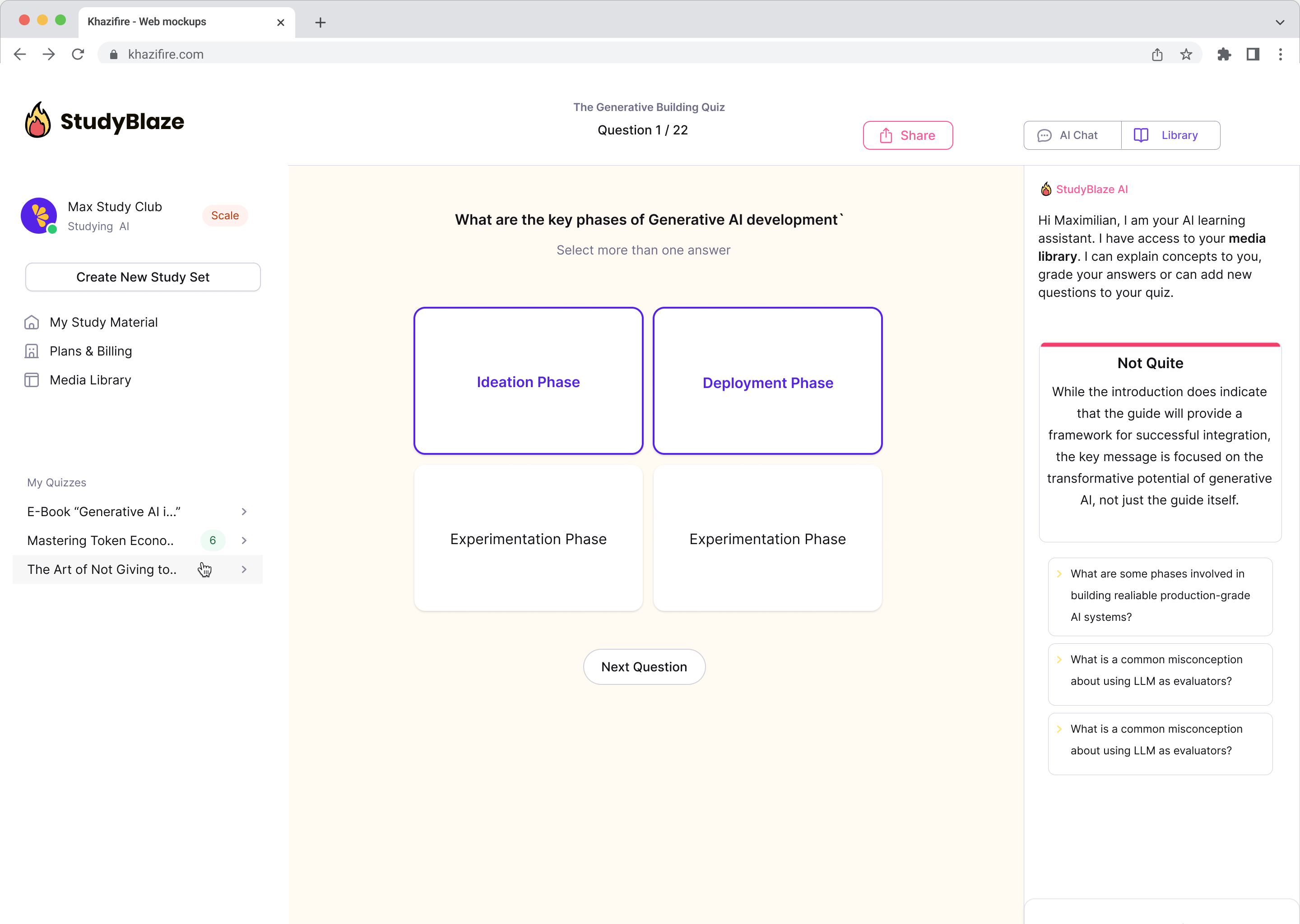
Atnaujinkite savo mokymosi įpročius
Su StudyBlaze galite iš karto pagerinti savo mokymosi greitį. Užuot nuolat skaitydami nuobodžią medžiagą, greičiau pasitikrinkite savo žinias be valandų neautomatinio atminties kortelės ir santraukų kūrimo.
