Generatore di intelligenza artificiale per
Quiz, Flashcards
& Di Più
Trasforma i tuoi noiosi contenuti di studio in fogli di lavoro, quiz, flashcard e domande di pratica interattivi basati sull'intelligenza artificiale con un clic di un pulsante. Carica PDF, documenti, audio e video oggi stesso per iniziare.
Interrompere il lavoro manuale
La maggior parte degli studenti spreca tempo con metodi di apprendimento inefficienti
Invece di rileggere lunghi documenti o di creare manualmente schede e riassunti per ore, ti aiutiamo a saltare questi passaggi.
Smettila di annegare nelle informazioni e lascia che la nostra IA filtri ciò che è davvero importante. Inizia subito a metterti alla prova e migliora più velocemente.
Sono davvero poche le persone che possono permettersi un tutor personale. StudyBlaze cambia tutto questo per sempre. L'apprendimento interattivo rende i tuoi progressi 10 volte più rapidi.
Creare manualmente materiali di studio è tempo che potresti impiegare per allenarti e metterti alla prova. Riduci lo stress eliminando completamente il lavoro manuale.
Un tutor AI disponibile 24 ore su 7, XNUMX giorni su XNUMX
Avere accesso a un tutor ogni giorno
Ricevi un feedback immediato sulle tue risposte
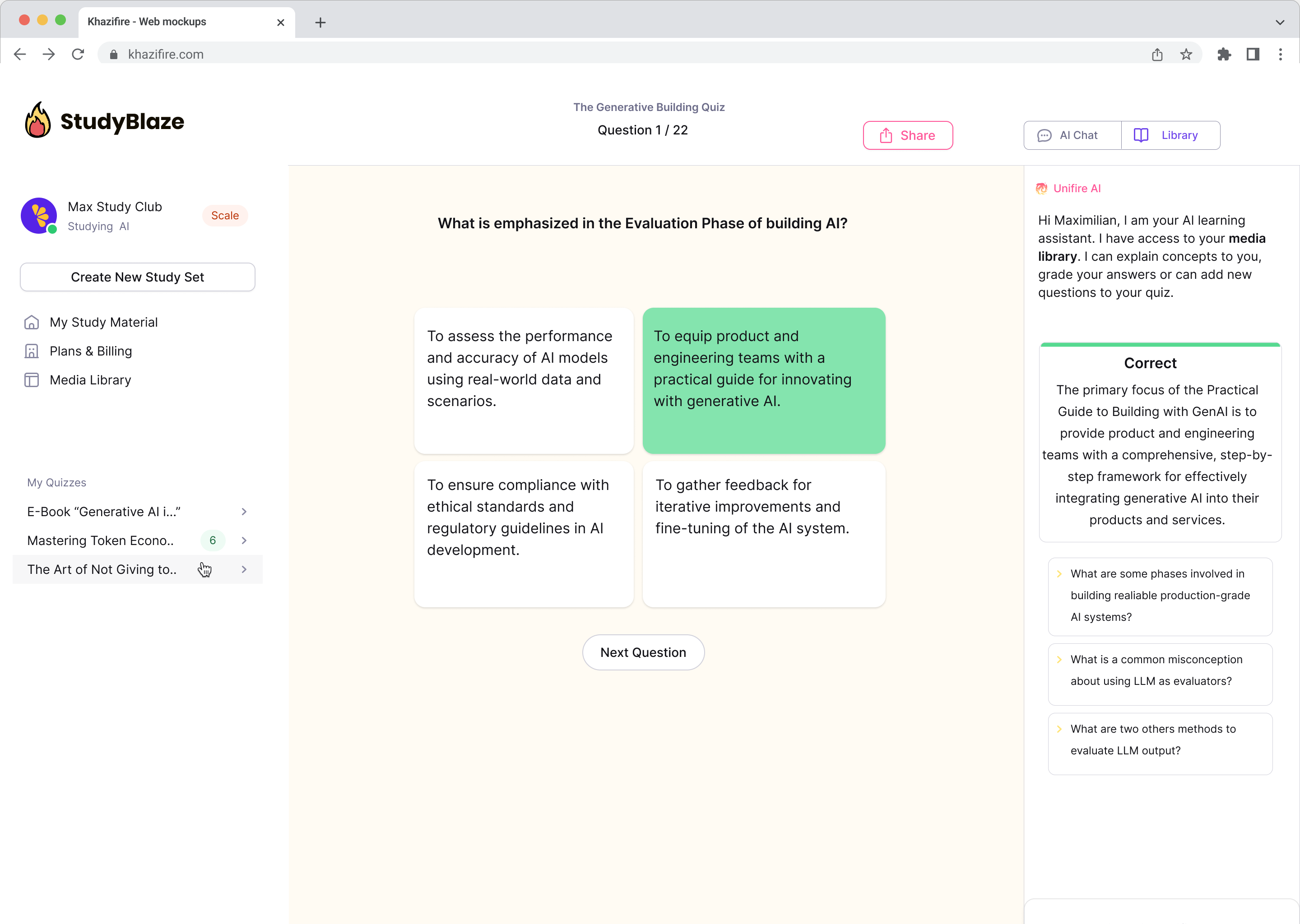
Chatta con i tuoi documenti e comprendi più velocemente gli argomenti complessi
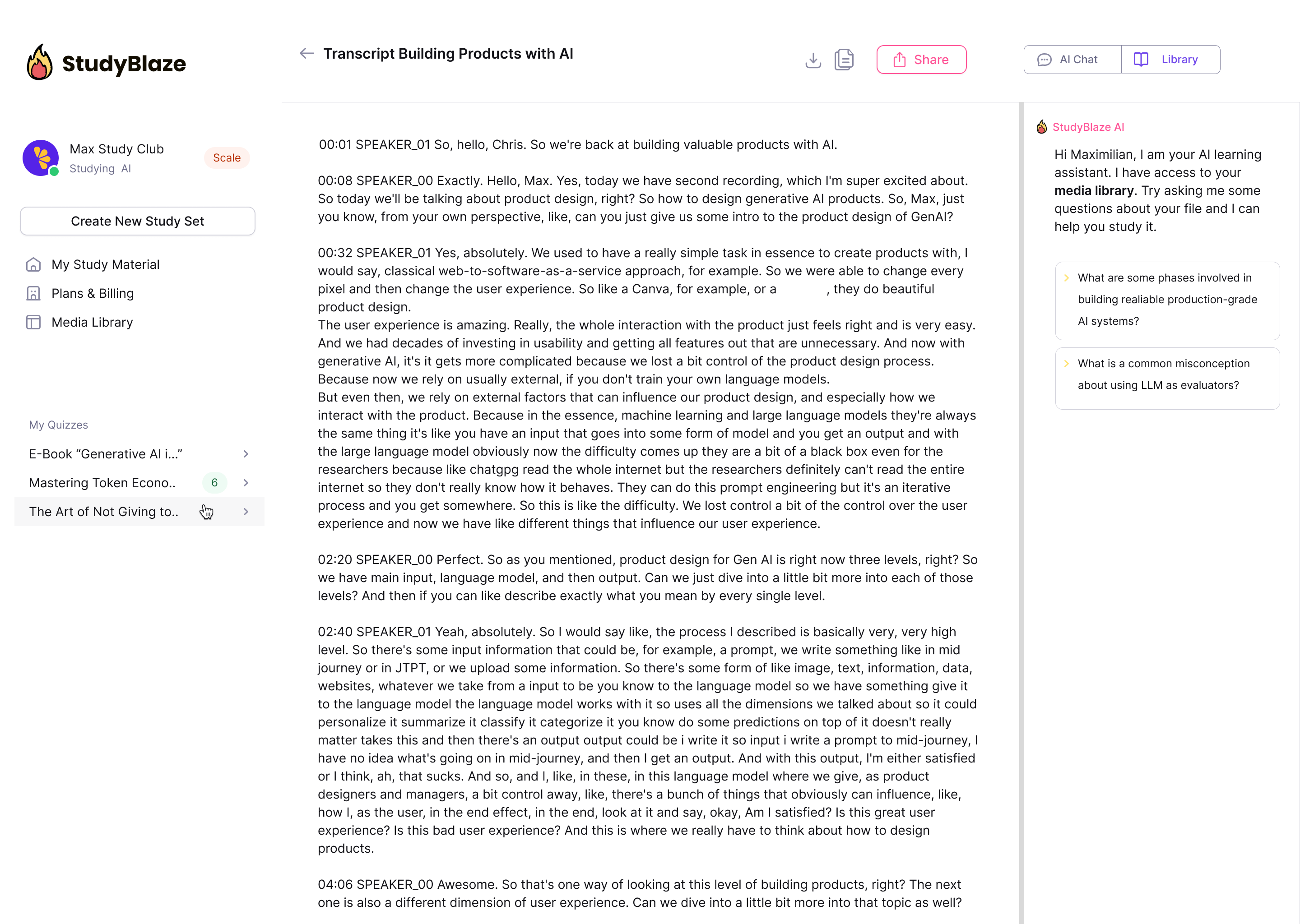
Lascia che il tuo tutor AI valuti le tue risposte e ti dica cosa ti sei perso
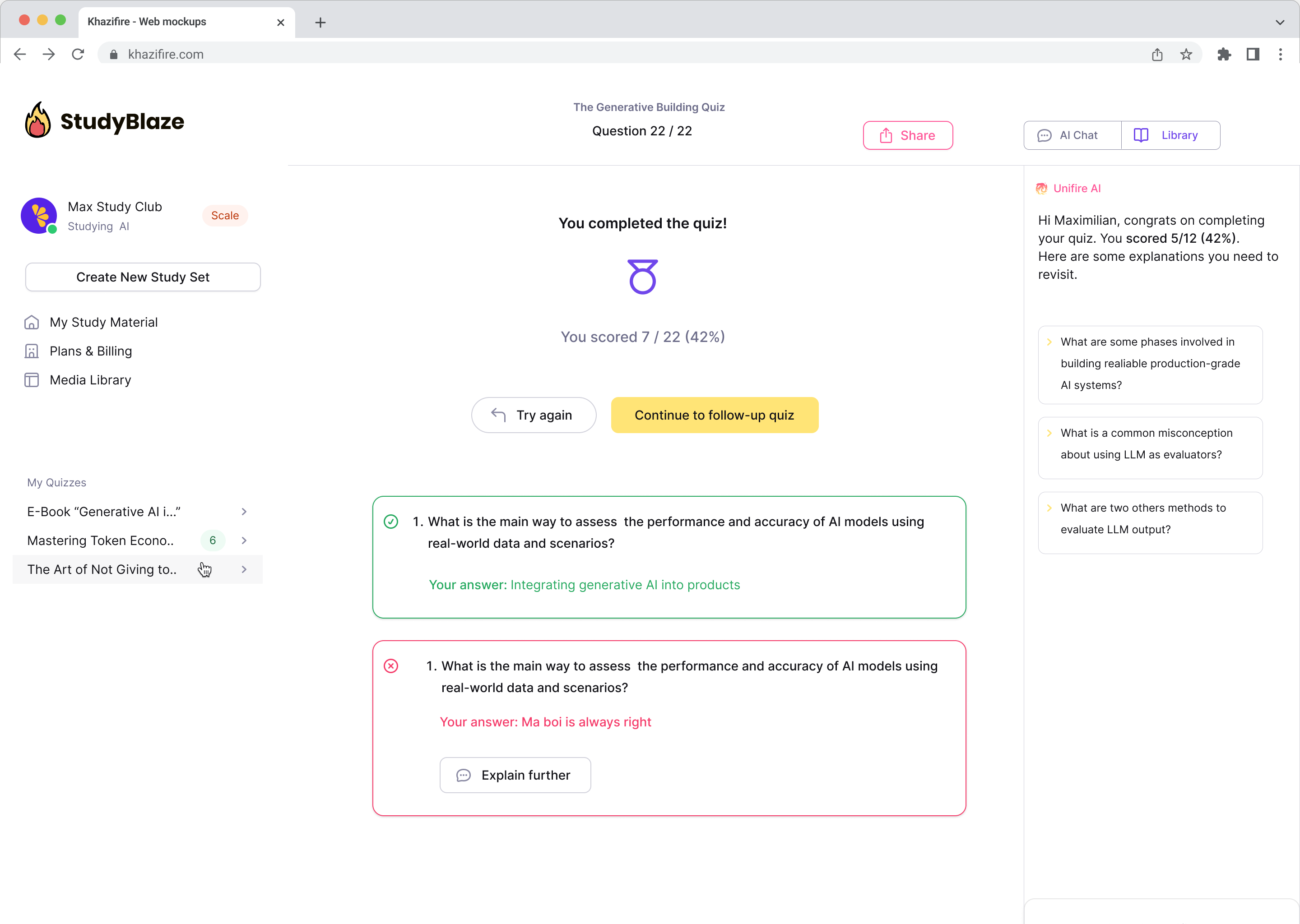
Domande più popolari
Rispondiamo alle domande più importanti che utenti come te hanno.
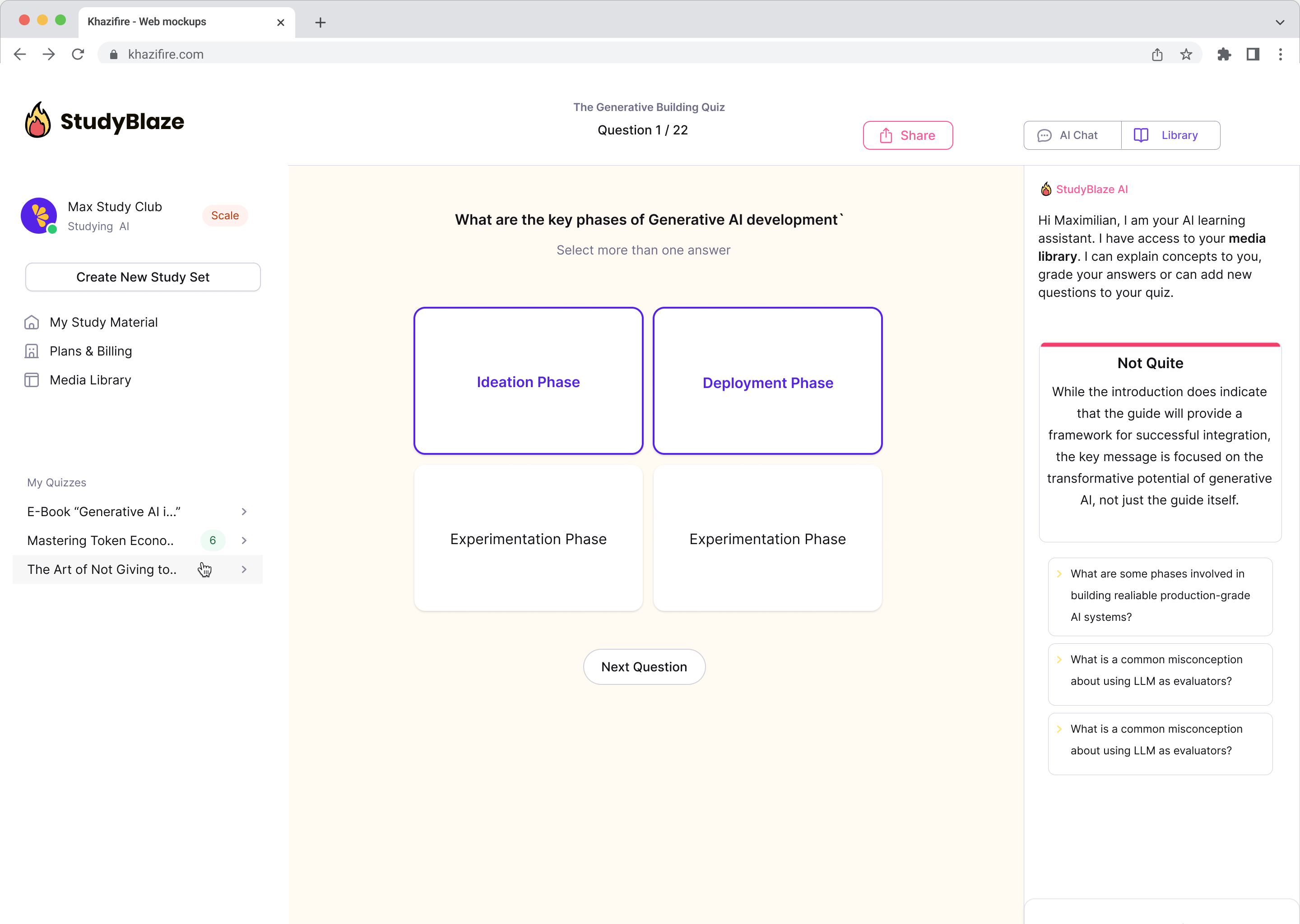
Migliora le tue abitudini di studio
Con StudyBlaze puoi migliorare immediatamente la tua velocità di apprendimento. Invece di leggere materiali noiosi più e più volte, puoi testare le tue conoscenze più velocemente senza ore di creazione manuale di flashcard e riassunti.
