AI rafall fyrir
Skyndipróf, Flashcards
& Meira
Umbreyttu leiðinlegu námsefninu þínu í gagnvirk gervigreind-knúin vinnublöð, skyndipróf, leifturspjöld og æfingaspurningar með því að smella á hnappinn. Hladdu upp PDF skjölum, skjölum, hljóði og myndskeiðum í dag til að byrja.
Hættu handavinnunni
Flestir nemendur eyða tíma í óhagkvæmar námsaðferðir
Í stað þess að lesa löngu skjölin þín aftur eða búa til spjaldspjöld og samantektir handvirkt í marga klukkutíma, hjálpum við þér að sleppa þessum skrefum.
Hættu að drukkna í upplýsingum og láttu gervigreind okkar sía út það sem er virkilega mikilvægt. Byrjaðu fljótt að prófa sjálfan þig og bættu þig hraðar.
Mjög fáir hafa efni á persónulegum kennara. StudyBlaze breytir þessu að eilífu. Gagnvirkt nám gerir framfarir þínar 10x hraðari.
Að búa til námsefni handvirkt er tími sem þú gætir eytt í að þjálfa og prófa sjálfan þig. Dragðu úr streitu með því að útrýma handavinnu algjörlega.
Gervigreindarkennari í boði 24/7
Hafa aðgang að kennara á hverjum degi
Fáðu tafarlaus viðbrögð við svörunum þínum
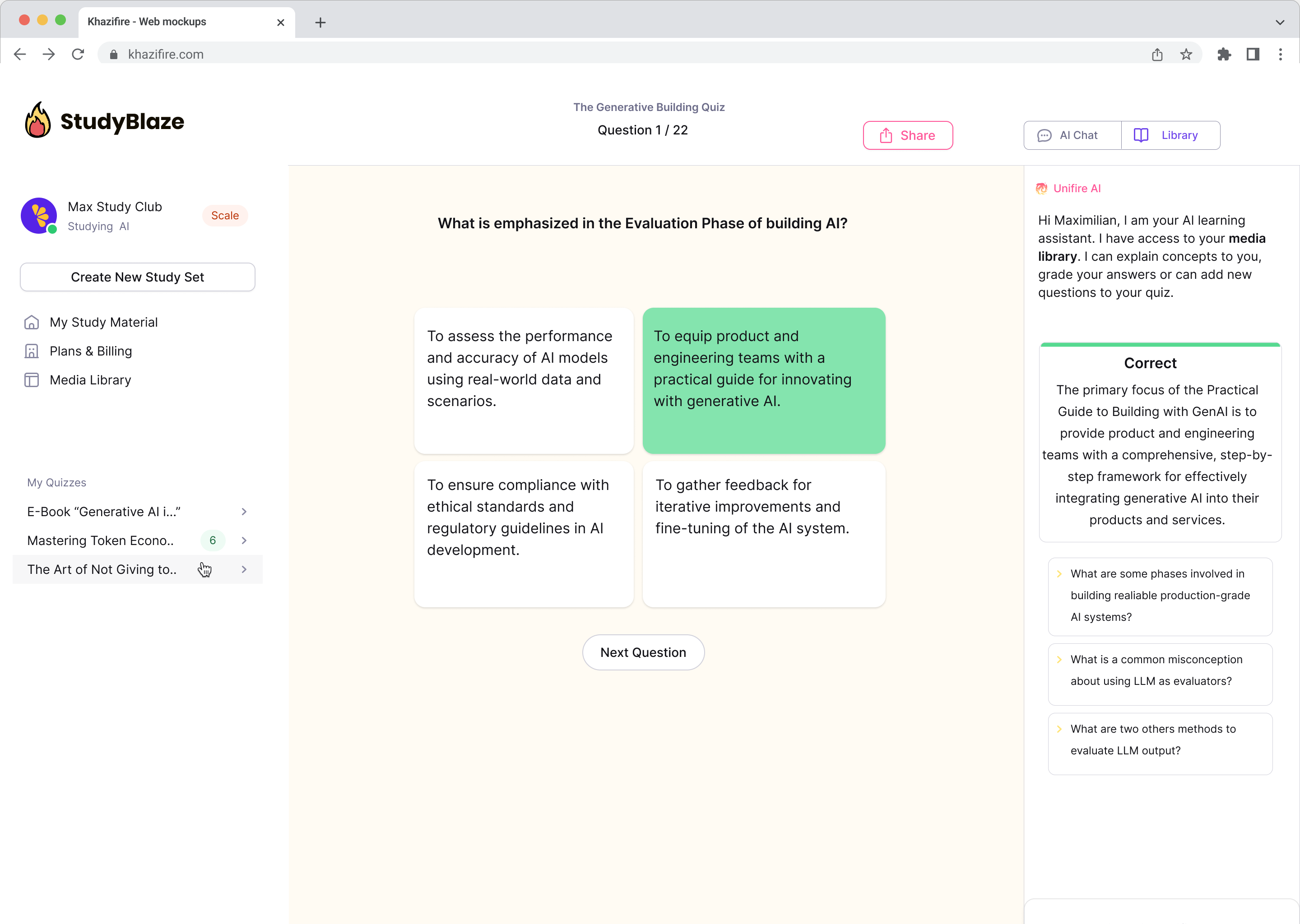
Spjallaðu við skjölin þín og skildu flókin efni hraðar
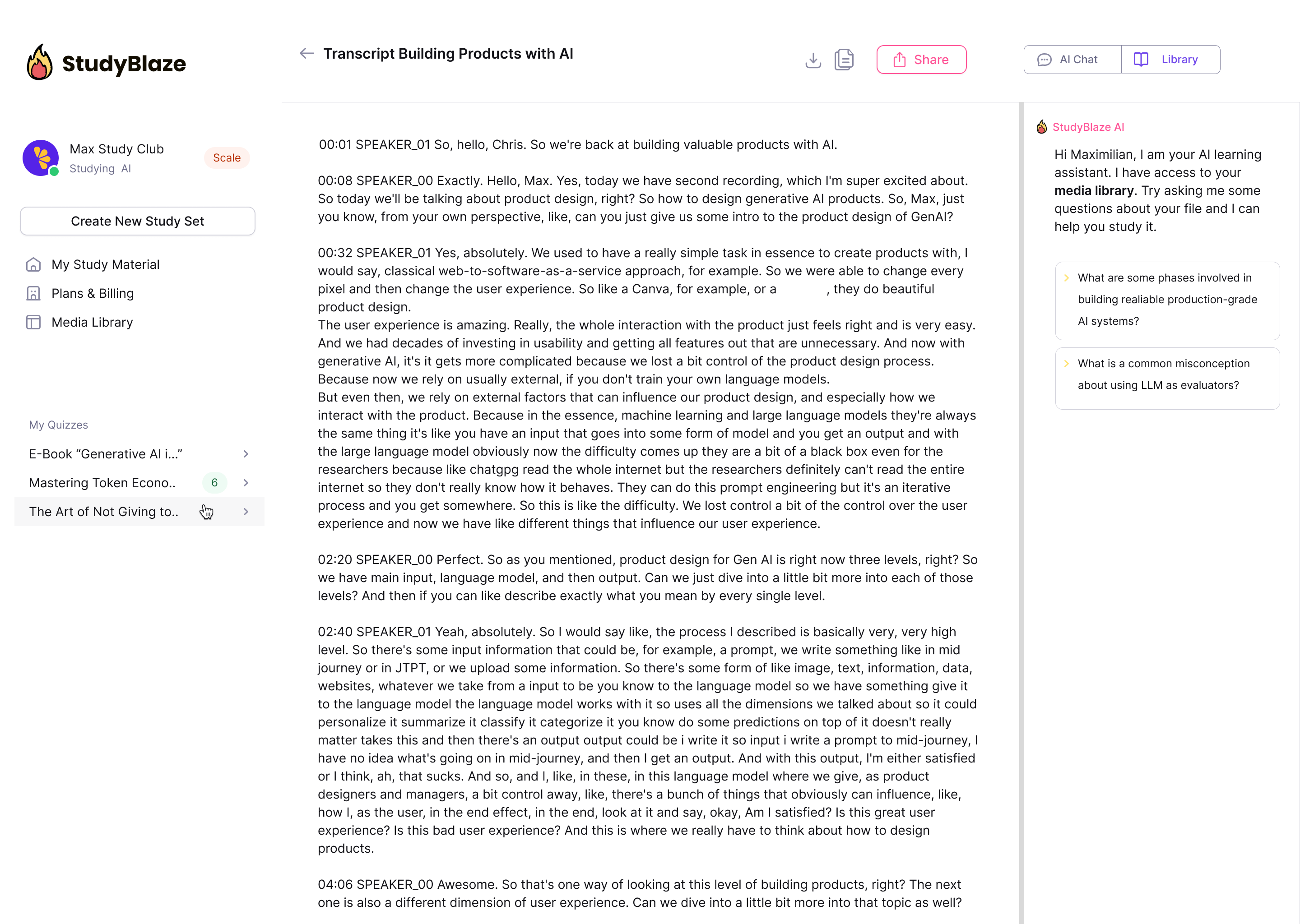
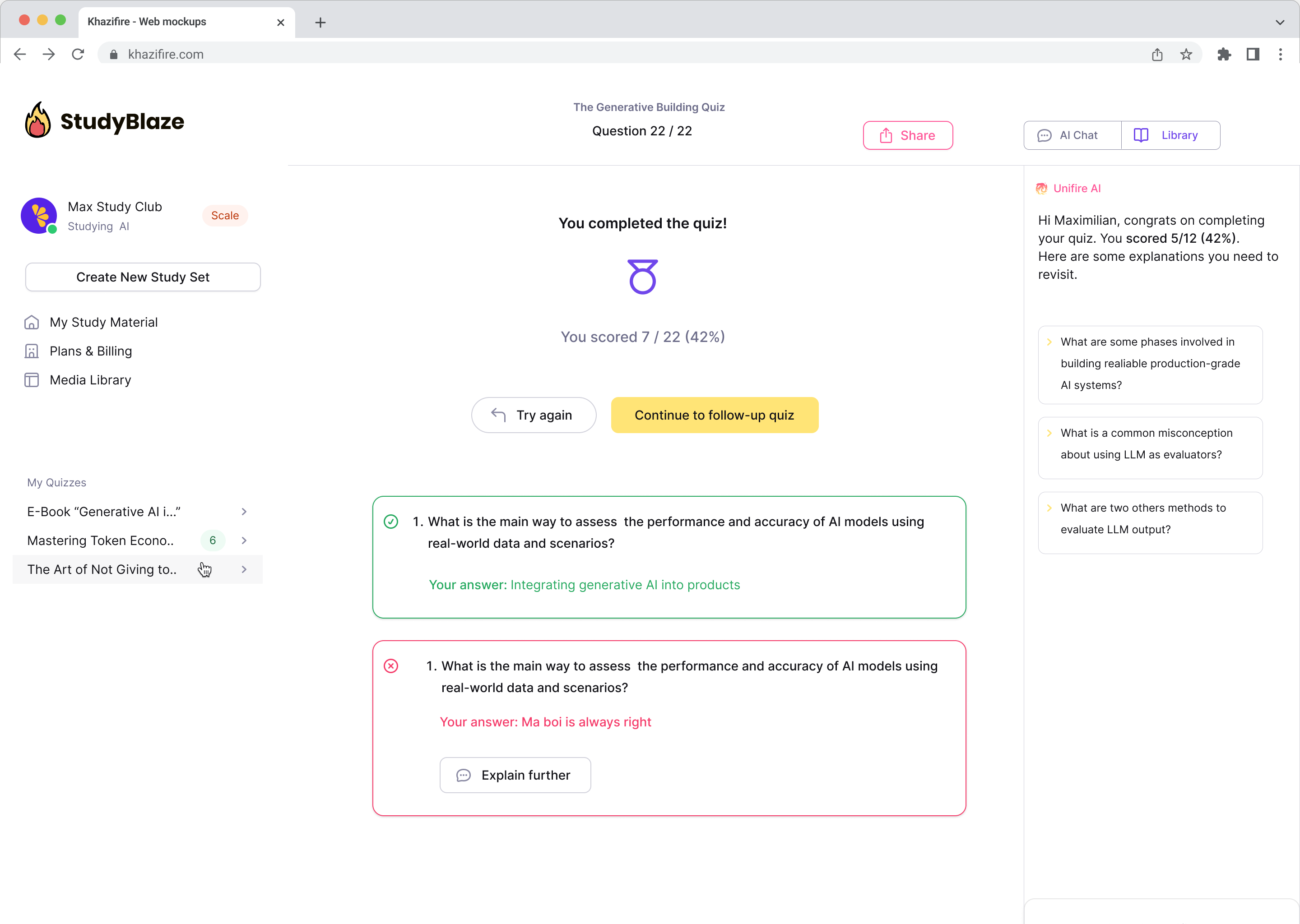
Láttu gervigreindarkennarann þinn gefa einkunn fyrir svörin þín og segja þér hverju þú misstir af
Vinsælustu spurningarnar
Við svörum mikilvægustu spurningunum sem notendur eins og þú hefur.
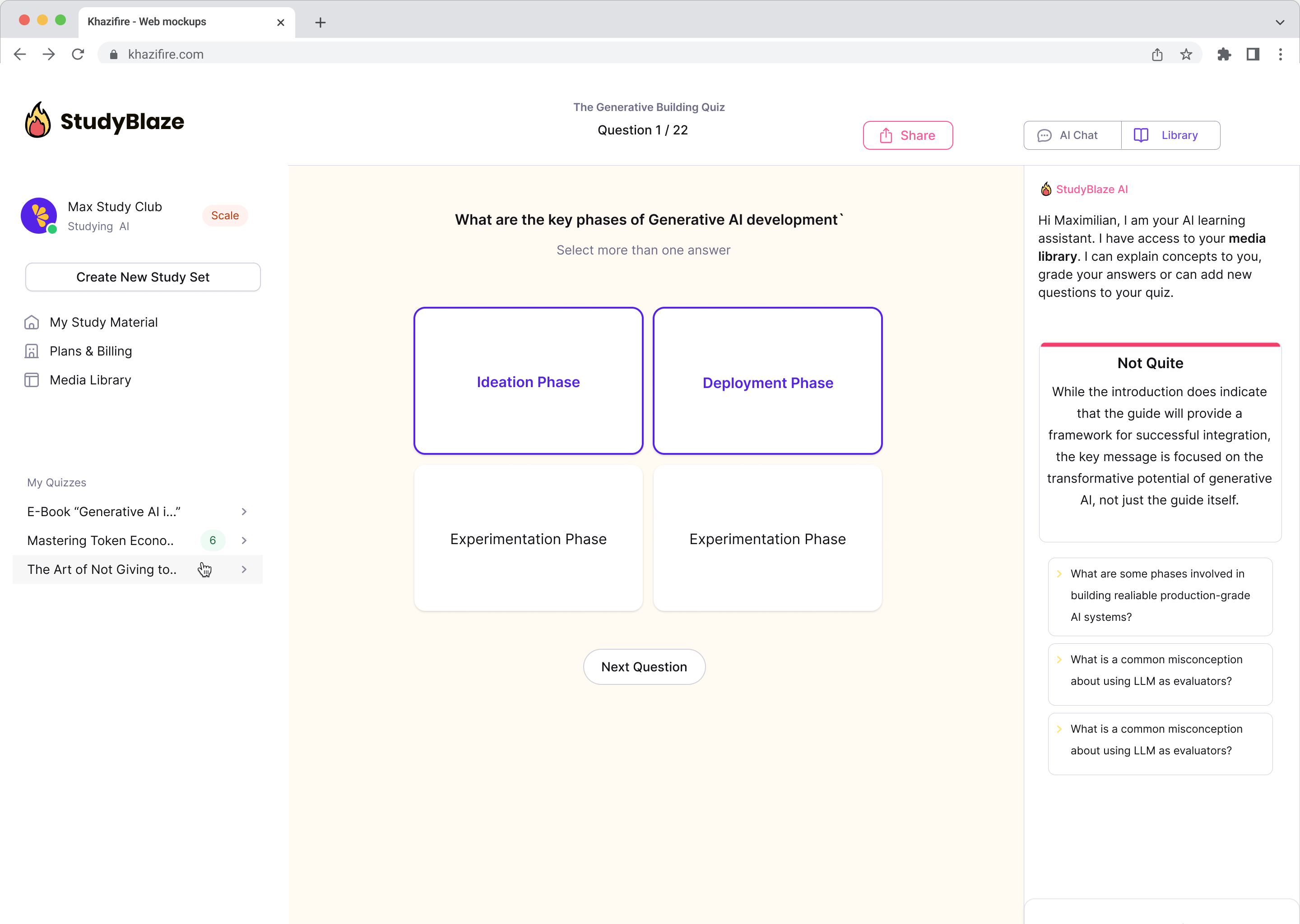
Uppfærðu námsvenjur þínar
Með StudyBlaze geturðu strax bætt námshraða þinn. Í stað þess að lesa leiðinlegt efni aftur og aftur, fáðu að prófa þekkingu þína hraðar án klukkustunda handvirkrar leifturkorta og samantektargerðar.
