AI generátor ehhez
Kvízek, kártyák
& Több
Alakítsa át unalmas tanulmányi tartalmát interaktív AI-alapú munkalapokká, vetélkedőkké, kártyákká és gyakorlati kérdésekké egyetlen kattintással. Töltsön fel PDF-eket, dokumentumokat, hangot és videót még ma a kezdéshez.
Hagyja abba a kézi munkát
A legtöbb diák nem hatékony tanulási módszerekre pazarolja idejét
Ahelyett, hogy újraolvassa a hosszú dokumentumokat, vagy manuálisan hozzon létre kártyákat és összefoglalókat órákon át, segítünk kihagyni ezeket a lépéseket.
Ne fulladj bele az információkba, és hagyd, hogy mesterséges intelligencia kiszűrje, mi az igazán fontos. Kezdje el gyorsan tesztelni magát, és gyorsabban fejlődjön.
Nagyon kevesen engedhetik meg maguknak a személyes oktatót. A StudyBlaze ezt örökre megváltoztatja. Az interaktív tanulás 10-szer gyorsabbá teszi a fejlődést.
A tananyagok manuális létrehozása olyan idő, amelyet képzéssel és önmaga tesztelésével tölthet. Csökkentse a stresszt a kézi munka teljes kiiktatásával.
AI-oktató a hét minden napján, 24 órában elérhető
Minden nap hozzáférhet egy oktatóhoz
Azonnali visszajelzést kaphat válaszairól
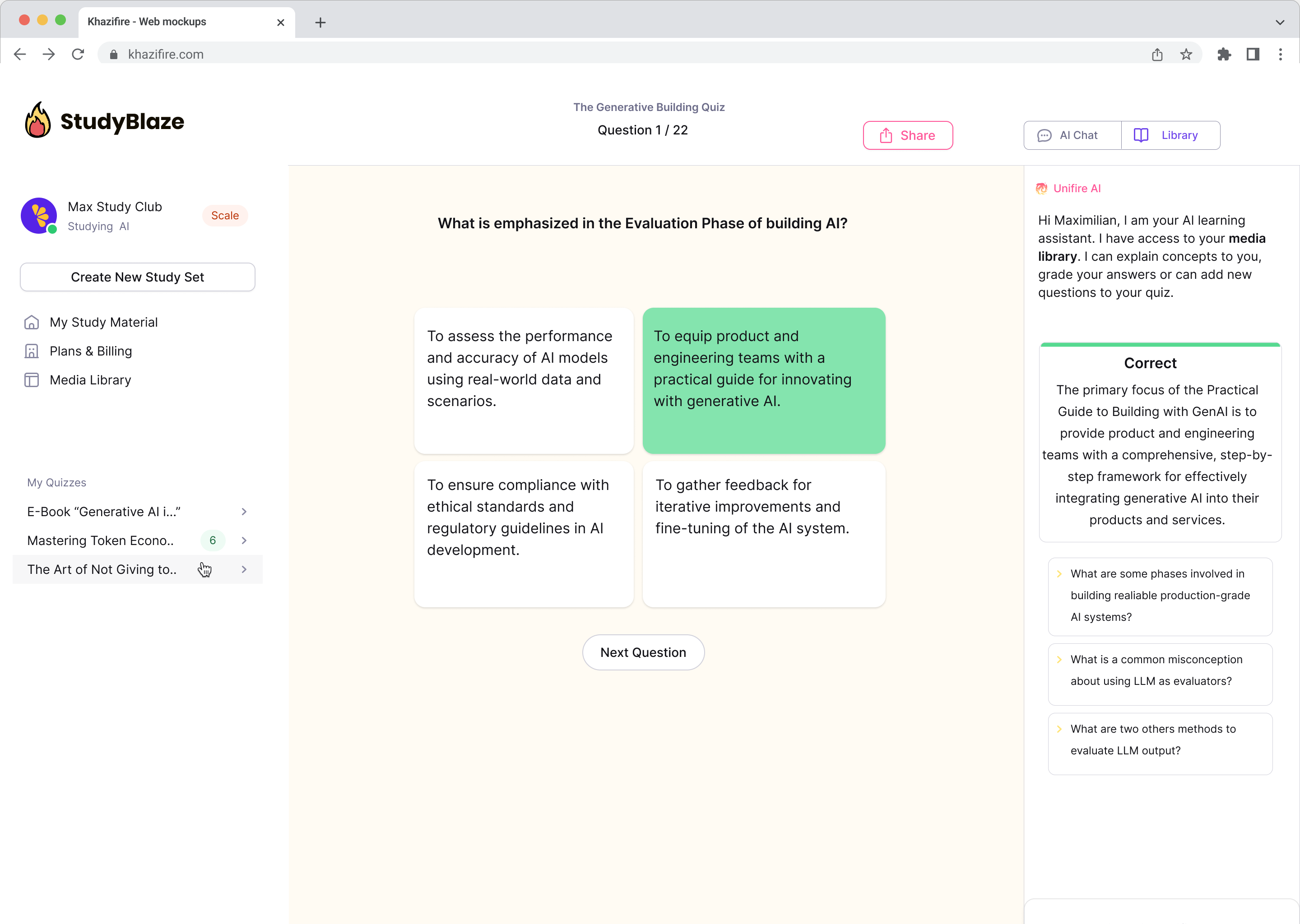
Csevegés a dokumentumokkal, és gyorsabban megértheti az összetett témákat
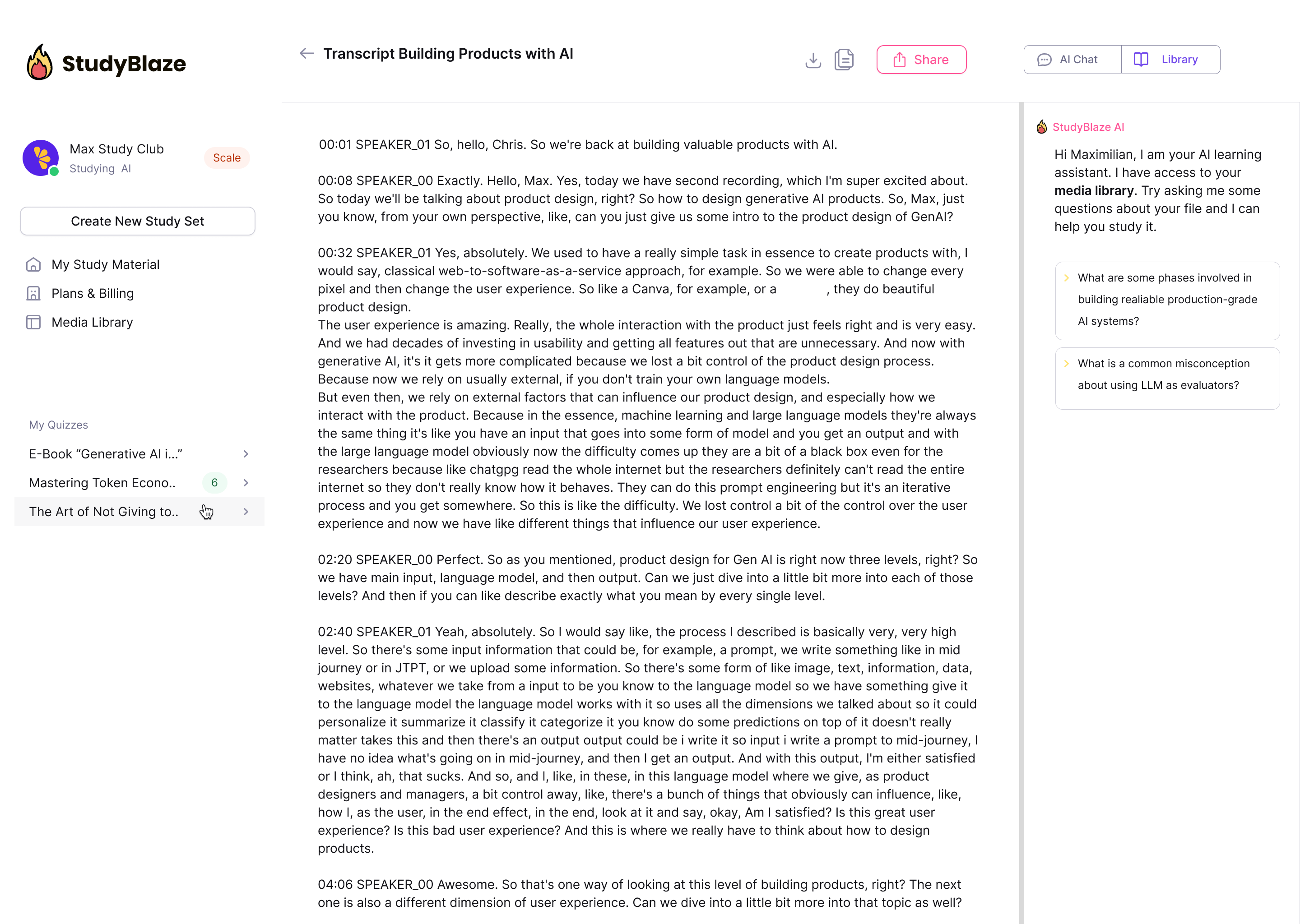
Hagyja, hogy mesterséges intelligencia oktatója értékelje válaszait, és elmondja, mit hagyott ki
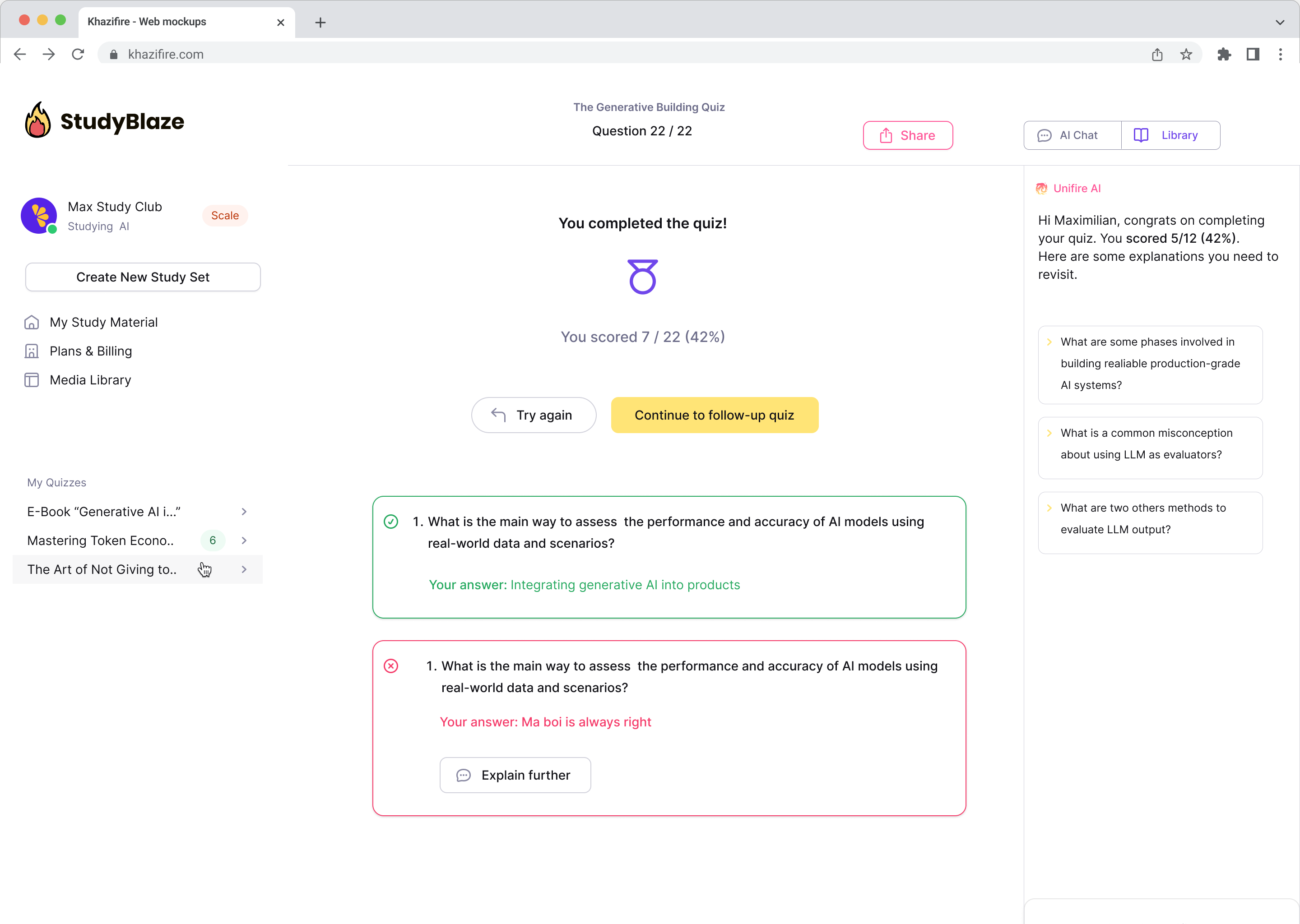
A legnépszerűbb kérdések
Megválaszoljuk a hozzád hasonló felhasználók legfontosabb kérdéseit.
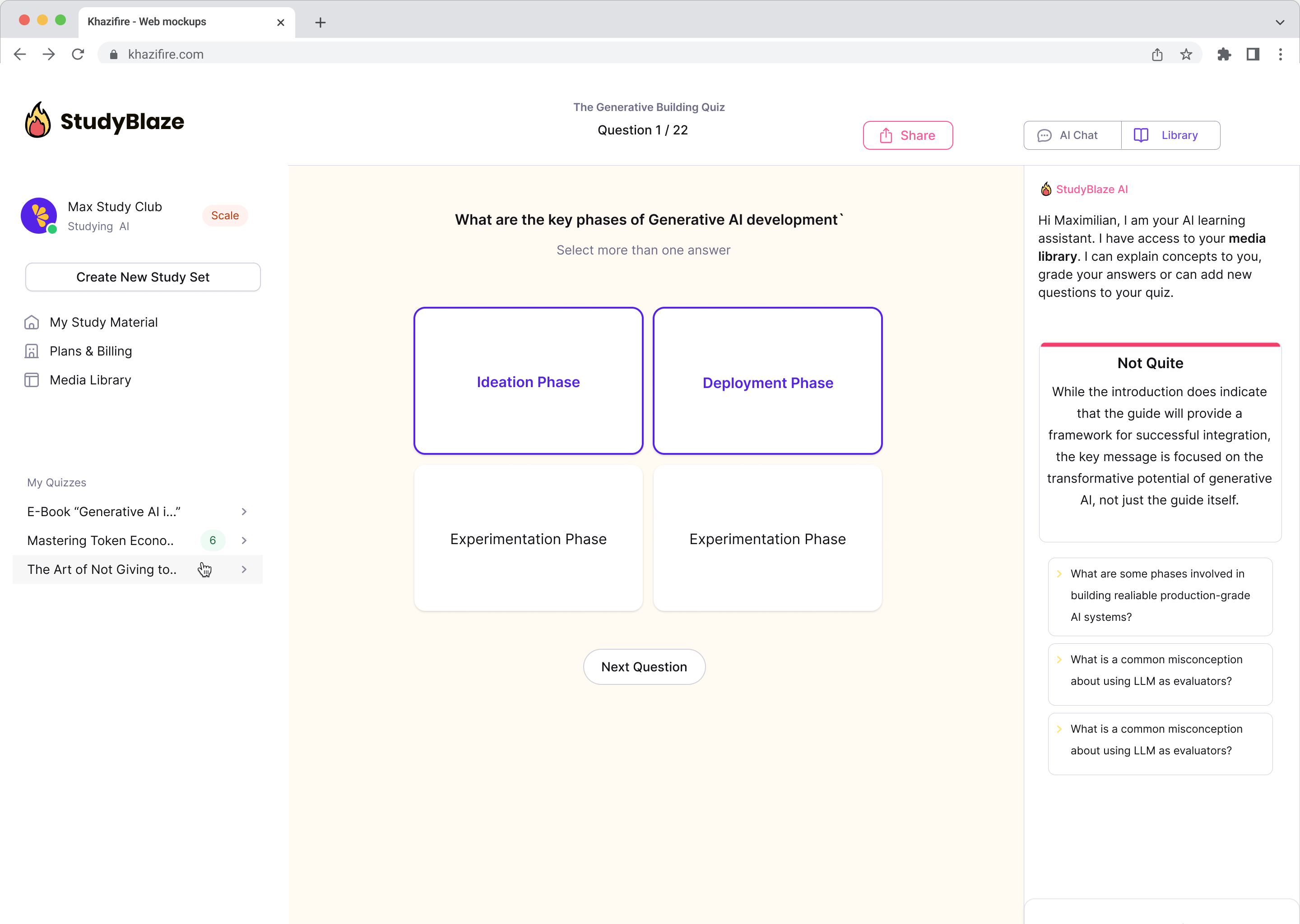
Frissítse tanulási szokásait
A StudyBlaze segítségével azonnal javíthatja tanulási sebességét. Ahelyett, hogy unalmas anyagokat olvasna újra és újra, gyorsabban próbára teheti tudását órákig tartó kézi kártyák és összefoglalók létrehozása nélkül.
