AI Generator za
Kvizovi, kartice
& Više
Pretvorite svoje dosadne sadržaje za učenje u interaktivne radne listove, kvizove, kartice i pitanja za vježbanje pomoću umjetne inteligencije jednim pritiskom na gumb. Učitajte PDF-ove, dokumente, audio i video već danas da biste započeli.
Zaustavite ručni rad
Većina učenika gubi vrijeme na neučinkovite metode učenja
Umjesto da ponovno čitate svoje duge dokumente ili satima ručno kreirate kartice i sažetke, pomažemo vam da preskočite ove korake.
Prestanite se utapati u informacijama i dopustite našoj umjetnoj inteligenciji da filtrira ono što je stvarno važno. Brzo se počnite testirati i brže napredujte.
Vrlo malo ljudi može si priuštiti osobnog učitelja. StudyBlaze to zauvijek mijenja. Interaktivno učenje čini vaš napredak 10 puta bržim.
Ručno kreiranje materijala za učenje vrijeme je koje možete potrošiti na obuku i testiranje. Smanjite stres potpunim uklanjanjem ručnog rada.
AI učitelj dostupan 24/7
Imajte pristup učitelju svaki dan
Primite trenutne povratne informacije o svojim odgovorima
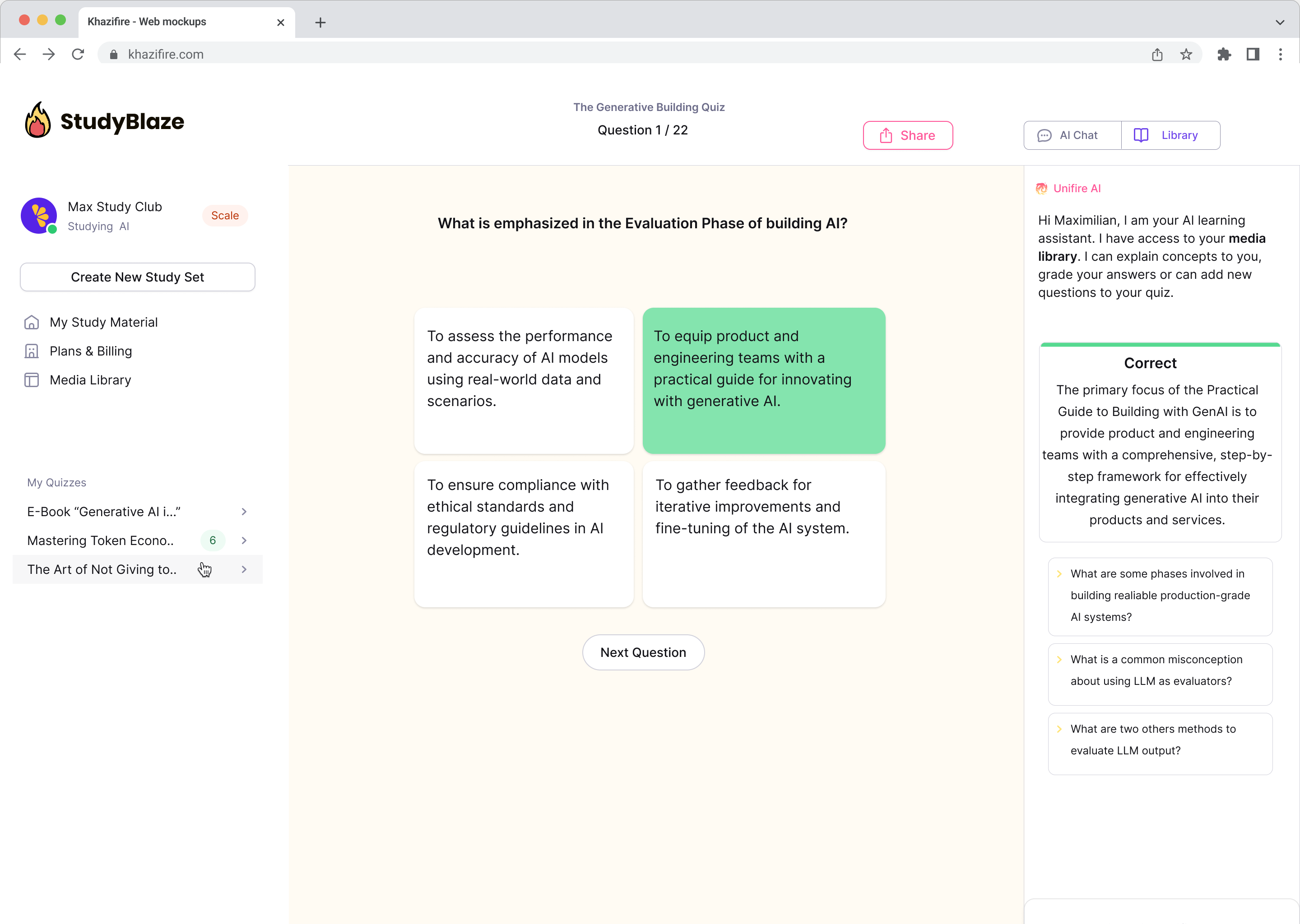
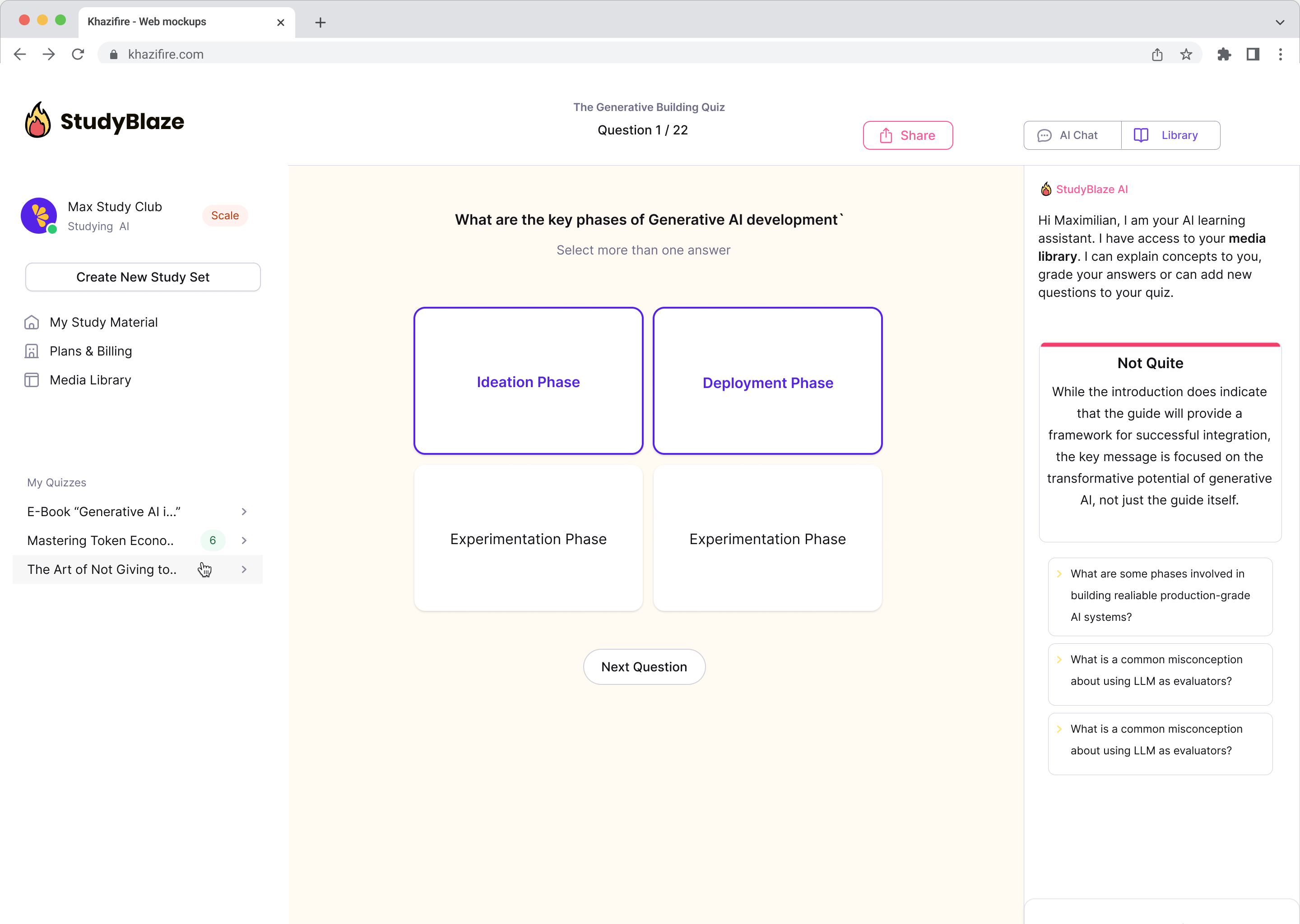
Razgovarajte sa svojim dokumentima i brže razumite složene teme
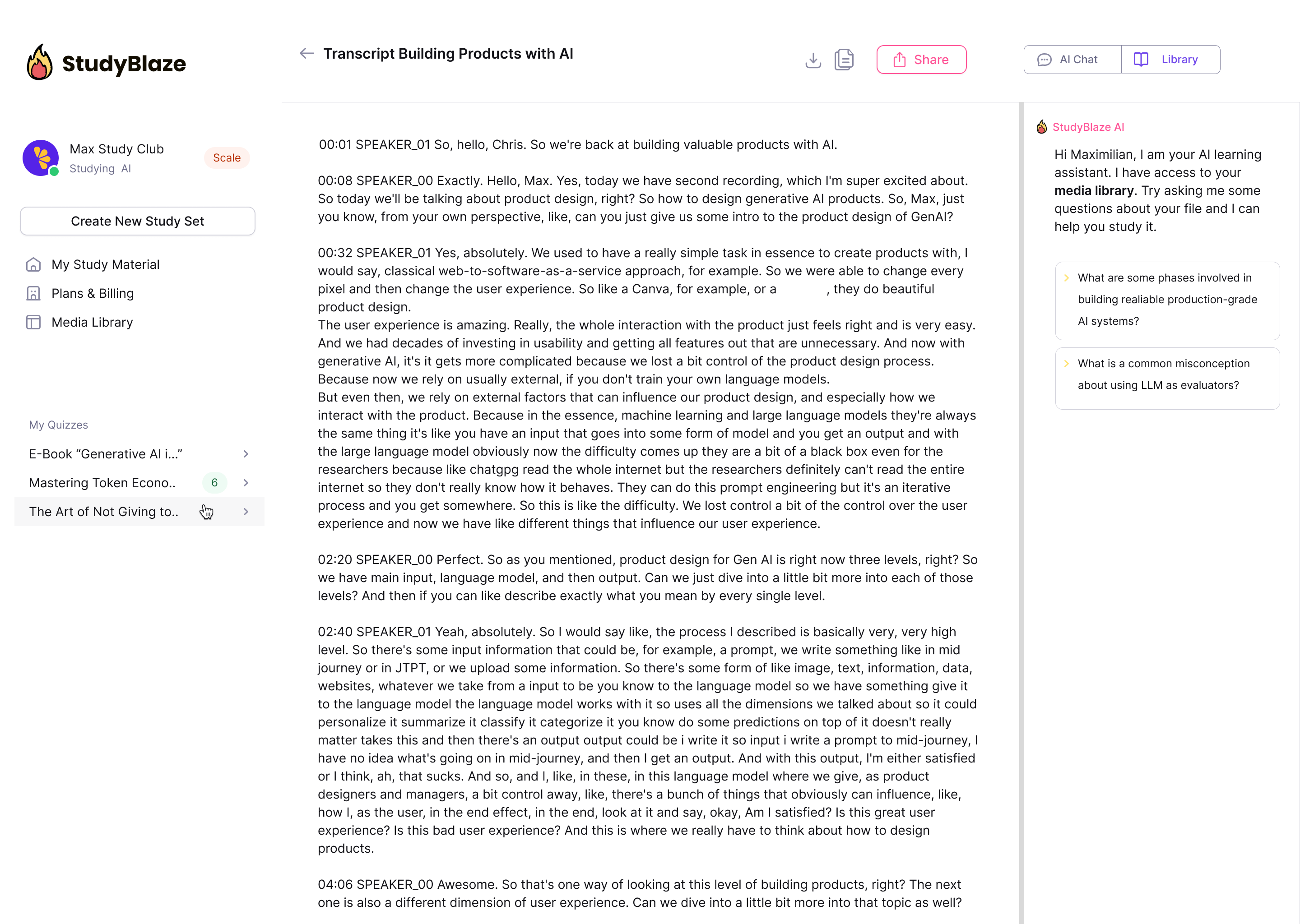
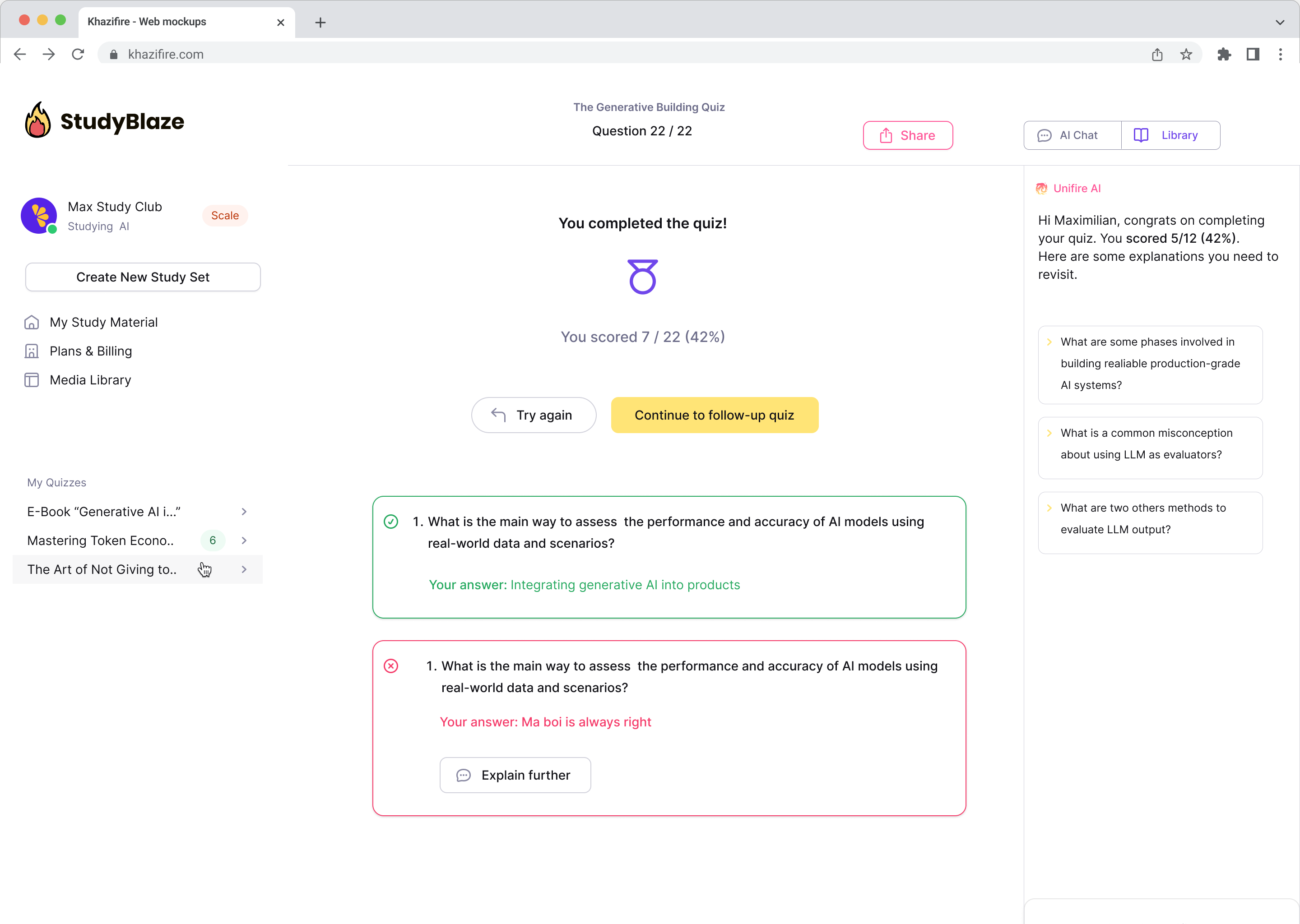
Neka vaš AI učitelj ocijeni vaše odgovore i kaže vam što ste propustili
Najpopularnija pitanja
Odgovaramo na najvažnija pitanja korisnika poput vas.
Nadogradite svoje navike učenja
Uz StudyBlaze možete odmah poboljšati svoju brzinu učenja. Umjesto čitanja dosadnih materijala iznova i iznova, provjerite svoje znanje brže bez sati ručnog kreiranja kartica i sažetaka.
