Générateur d'IA pour
Quiz, Flashcards
& Plus
Transformez votre contenu d'étude ennuyeux en feuilles de travail, questionnaires, flashcards et questions d'entraînement interactifs alimentés par l'IA en un seul clic. Téléchargez des PDF, des documents, des fichiers audio et des vidéos dès aujourd'hui pour commencer.
Arrêtez le travail manuel
La plupart des étudiants perdent du temps avec des méthodes d’apprentissage inefficaces
Au lieu de relire vos longs documents ou de créer manuellement des flashcards et des résumés pendant des heures, nous vous aidons à éviter ces étapes.
Arrêtez de vous noyer dans les informations et laissez notre IA filtrer ce qui est vraiment important. Commencez rapidement à vous tester et à vous améliorer plus rapidement.
Peu de personnes peuvent se permettre un professeur particulier. StudyBlaze change la donne. L'apprentissage interactif accélère vos progrès jusqu'à 10 fois.
La création manuelle de supports d'étude représente du temps que vous pourriez consacrer à vous former et à vous tester vous-même. Réduisez votre stress en éliminant entièrement le travail manuel.
Un tuteur IA disponible 24h/7 et XNUMXj/XNUMX
Avoir accès à un tuteur tous les jours
Recevez des commentaires instantanés sur vos réponses
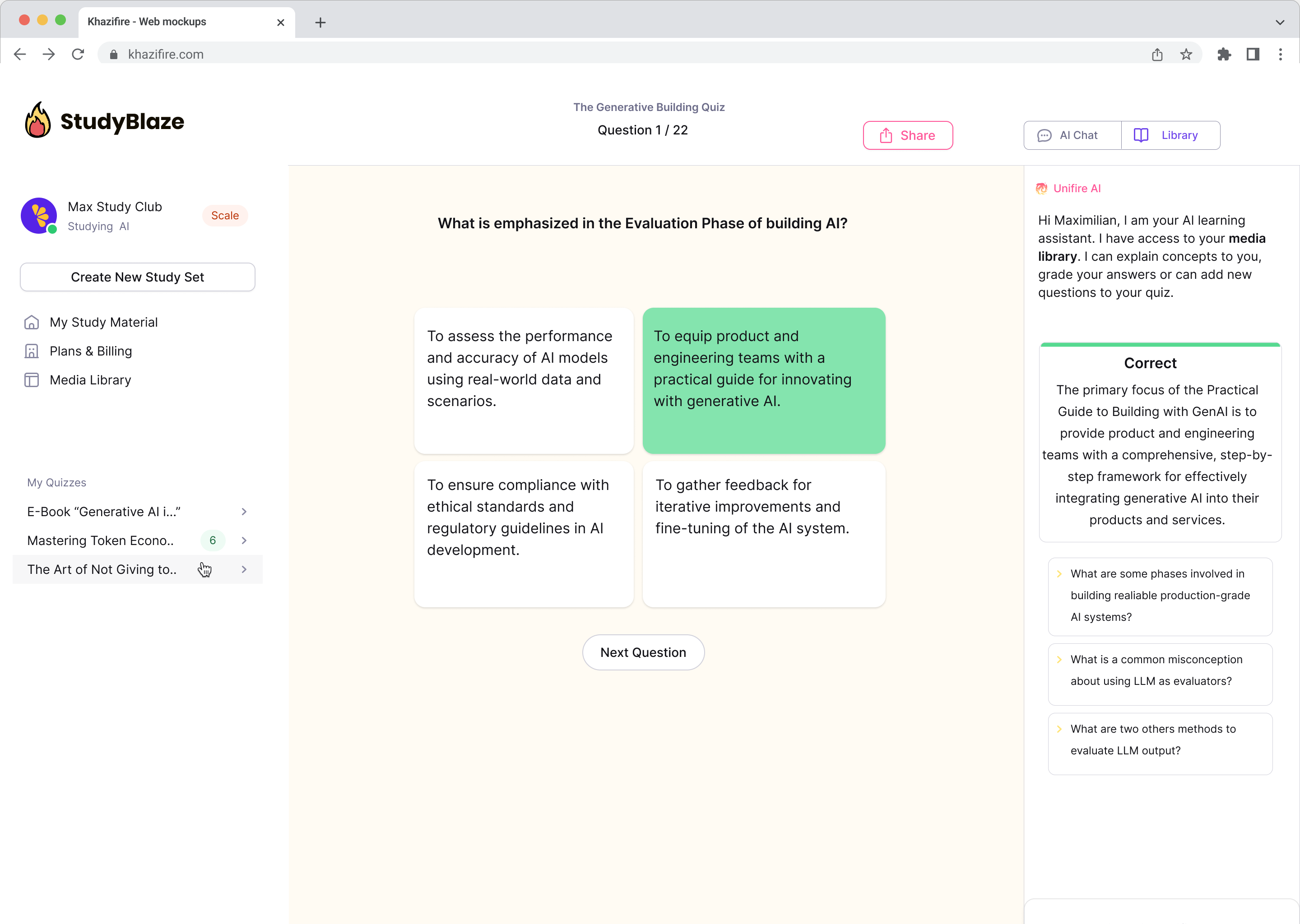
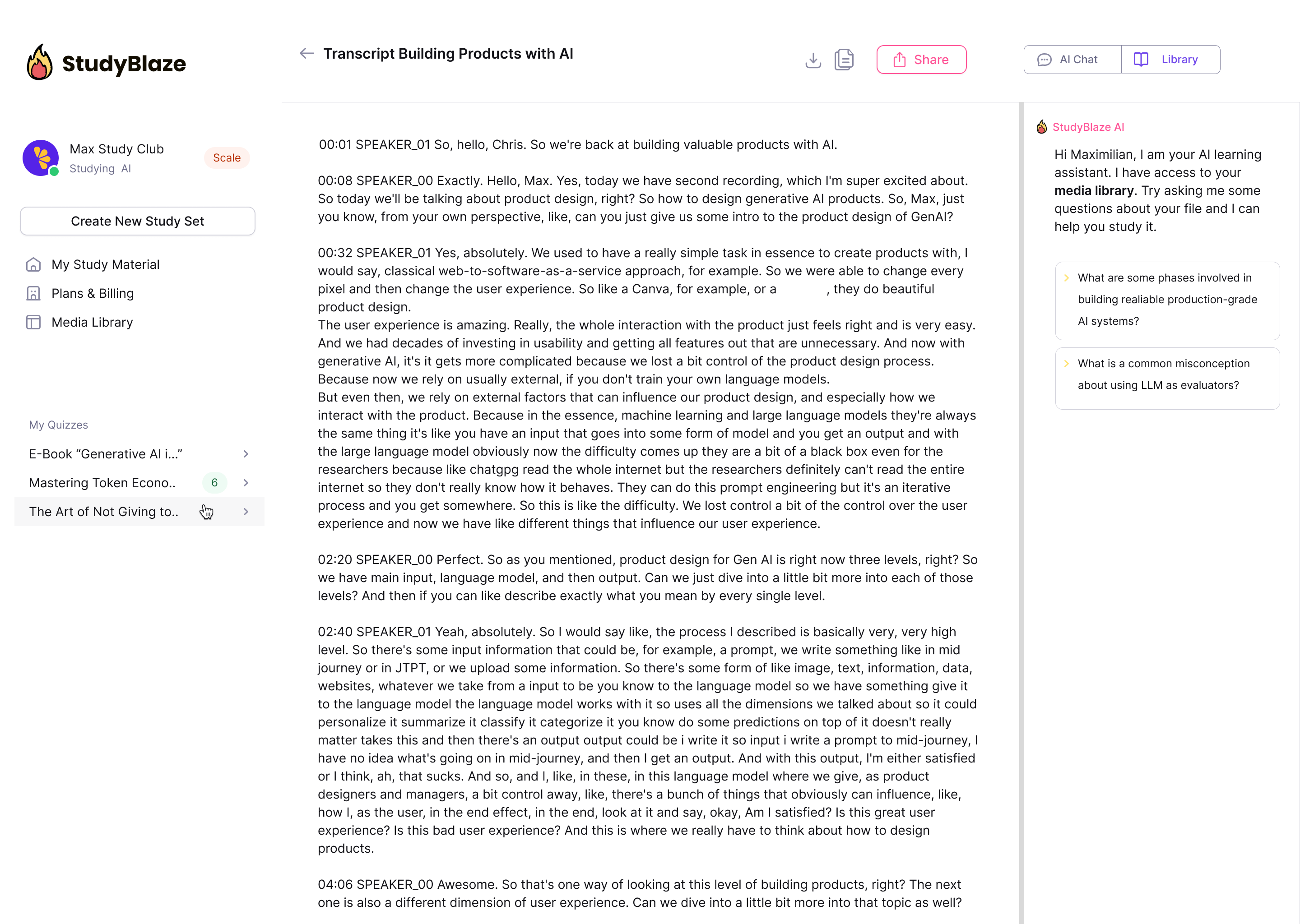
Discutez avec vos documents et comprenez plus rapidement les sujets complexes
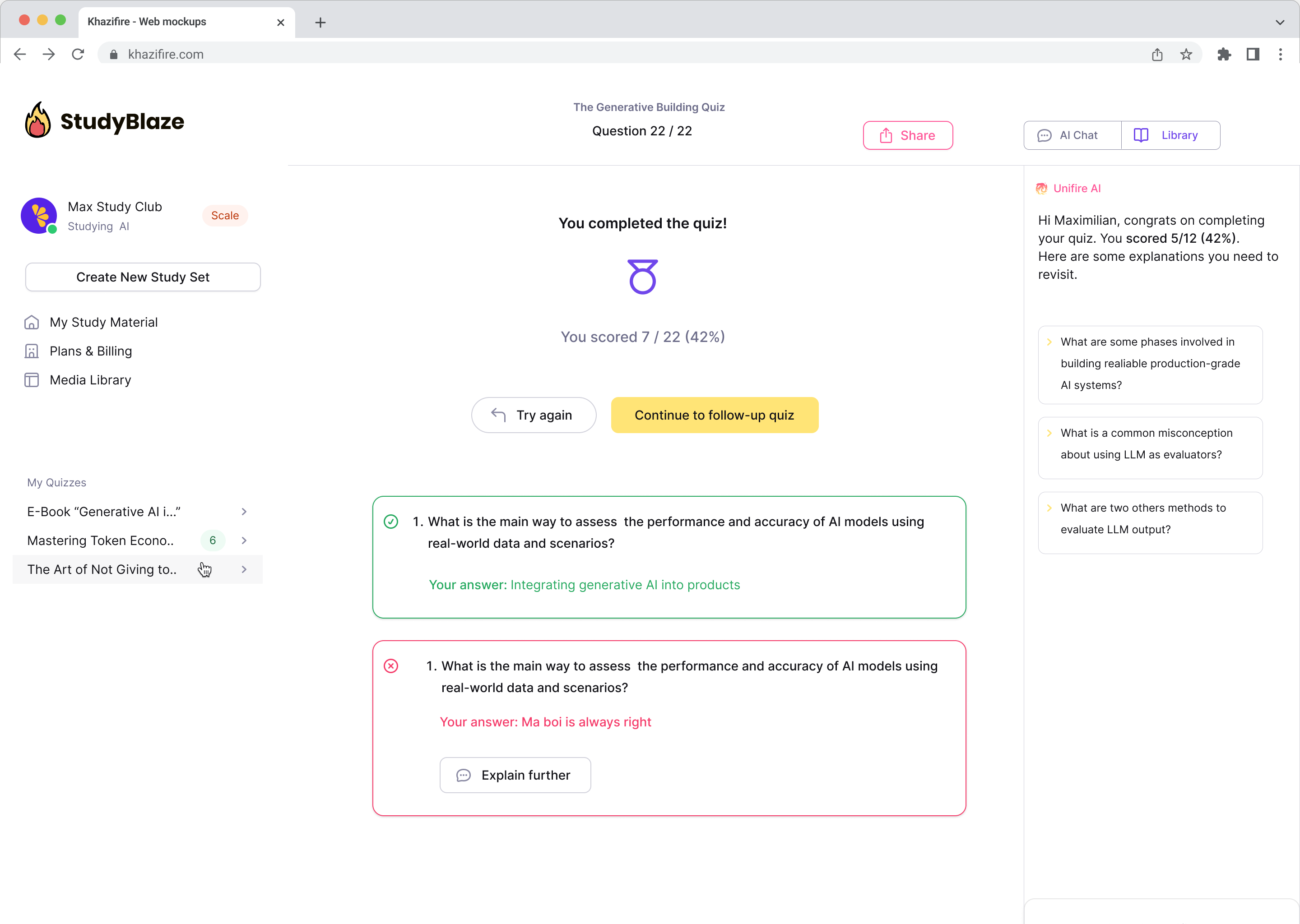
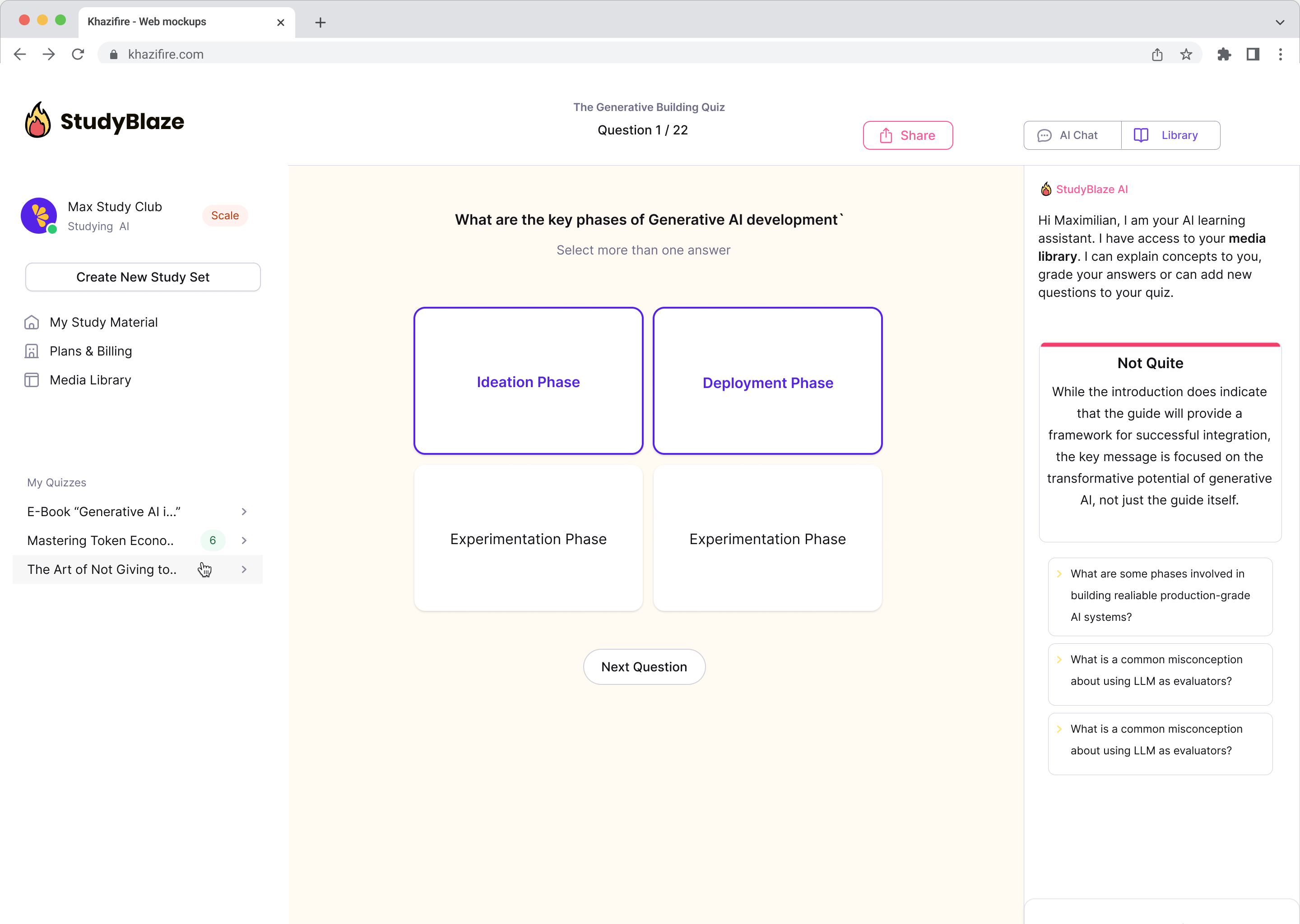
Laissez votre tuteur IA noter vos réponses et vous dire ce que vous avez manqué
Questions les plus fréquentes
Nous répondons aux questions les plus importantes que se posent les utilisateurs comme vous.
Améliorez vos habitudes d'étude
Avec StudyBlaze, vous pouvez immédiatement améliorer votre vitesse d'apprentissage. Au lieu de lire des documents ennuyeux encore et encore, testez vos connaissances plus rapidement sans passer des heures à créer manuellement des fiches et des résumés.
