AI-generaattori varten
Tietokilpailut, Flashcards
& Lisää
Muunna tylsä opiskelusisältösi interaktiivisiksi tekoälypohjaisiksi laskentataulukoiksi, tietokilpailuiksi, muistikorteiksi ja harjoituskysymyksiksi yhdellä napin painalluksella. Aloita lataamalla PDF-tiedostoja, asiakirjoja, ääntä ja videota tänään.
Lopeta manuaalinen työ
Suurin osa oppilaista tuhlaa aikaa tehottomiin oppimismenetelmiin
Sen sijaan, että lukisit pitkiä asiakirjojasi uudelleen tai luot käsin muistikortteja ja yhteenvetoja tuntikausia, autamme sinua ohittamaan nämä vaiheet.
Älä hukku tietoon ja anna tekoälymme suodattaa todella tärkeät asiat. Aloita nopeasti itsesi testaus ja kehity nopeammin.
Hyvin harvalla on varaa henkilökohtaiseen ohjaajaan. StudyBlaze muuttaa tämän pysyvästi. Interaktiivinen oppiminen nopeuttaa edistymistäsi 10 kertaa.
Oppimateriaalien luominen manuaalisesti on aikaa, jonka voit käyttää harjoittelemaan ja testaamaan itseäsi. Vähennä stressiä poistamalla manuaalinen työ kokonaan.
AI Tutor käytettävissä 24/7
Pääset tutoriin joka päivä
Saat välitöntä palautetta vastauksistasi
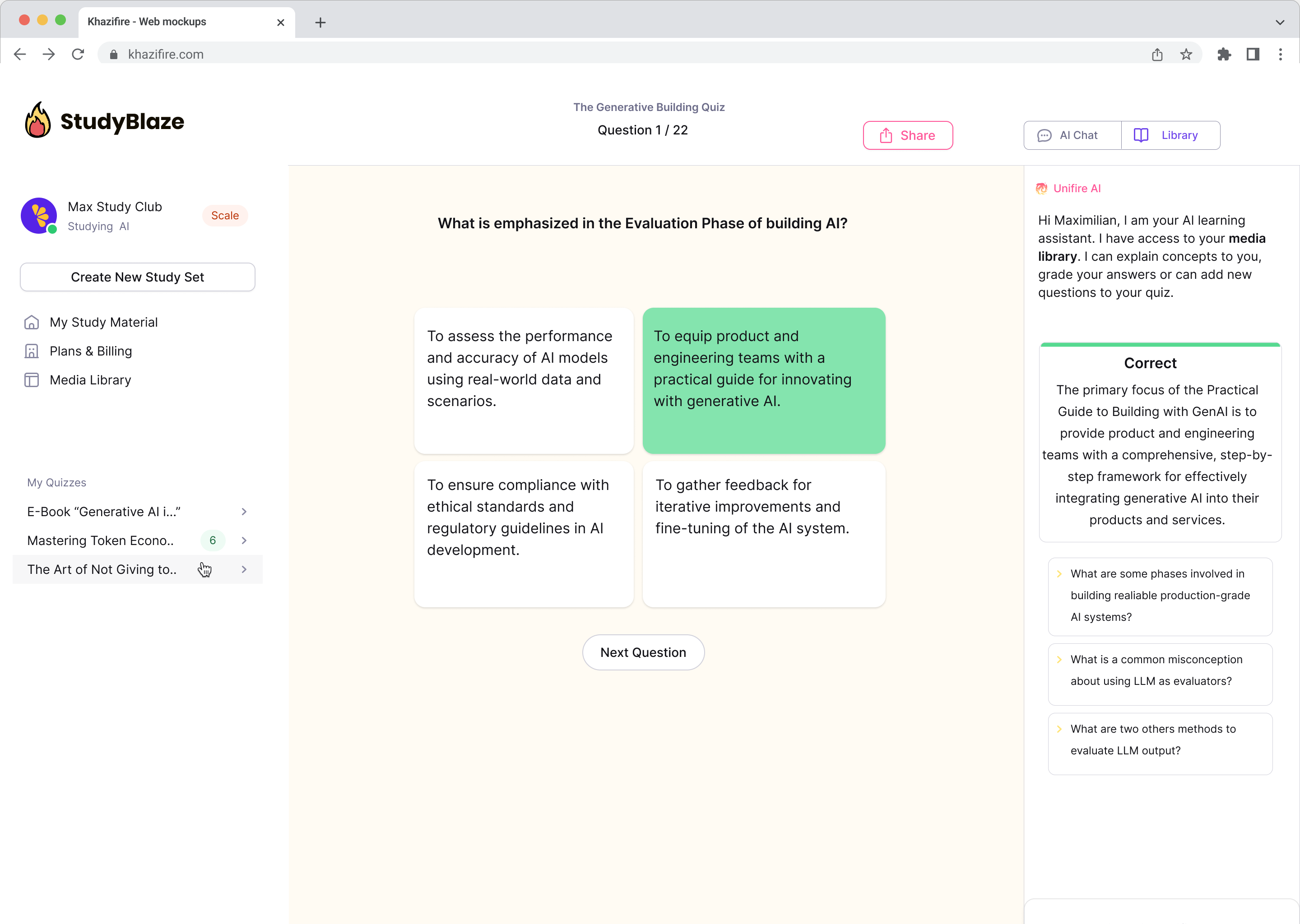
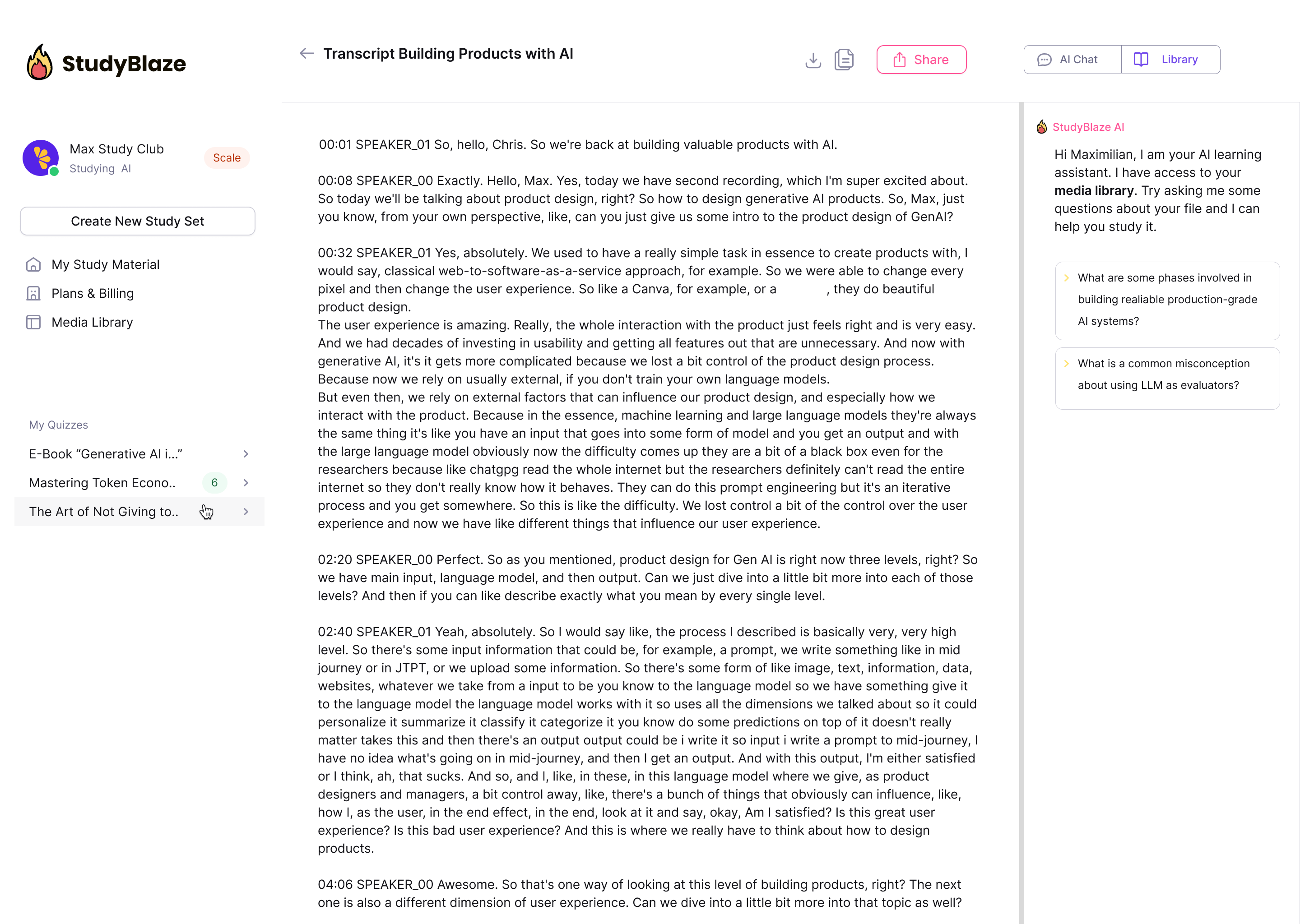
Keskustele asiakirjojen kanssa ja ymmärrä monimutkaisia aiheita nopeammin
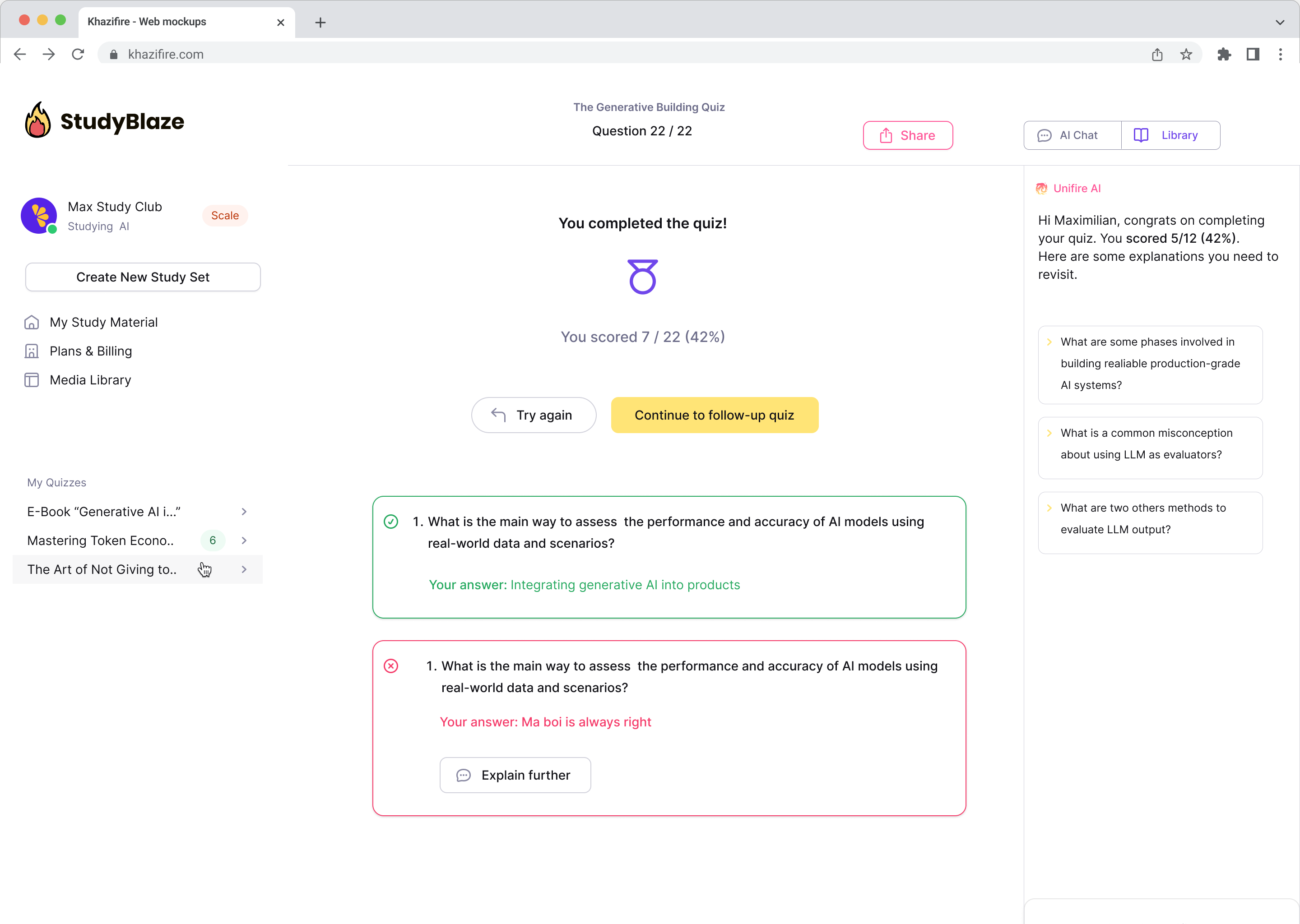
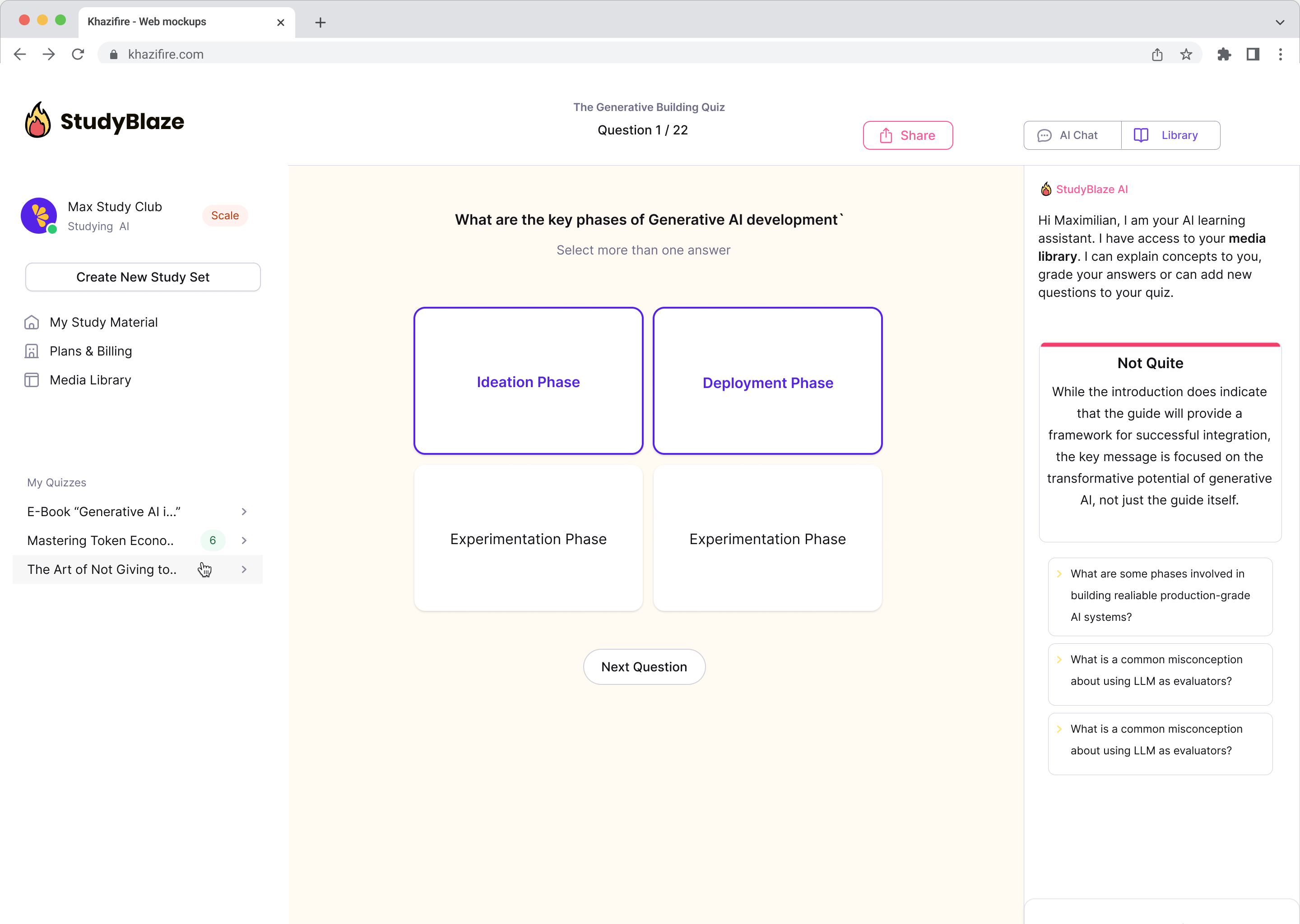
Anna tekoälyohjaajan arvioida vastauksesi ja kertoa, mitä sinulta jäi paitsi
Suosituimmat kysymykset
Vastaamme kaltaisesi käyttäjien tärkeimpiin kysymyksiin.
Päivitä opiskelutottumuksiasi
StudyBlazen avulla voit välittömästi parantaa oppimisnopeuttasi. Sen sijaan, että lukisit tylsää materiaalia uudestaan ja uudestaan, pääset testaamaan tietosi nopeammin ilman tuntien manuaalista muistikorttia ja yhteenvetojen luomista.
