Γεννήτρια AI για
Κουίζ, Flashcards
& Περισσότερο
Μετατρέψτε το βαρετό περιεχόμενο της μελέτης σας σε διαδραστικά φύλλα εργασίας με τεχνητή νοημοσύνη, κουίζ, flashcards και εξάσκηση σε ερωτήσεις με ένα πάτημα ενός κουμπιού. Ανεβάστε αρχεία PDF, έγγραφα, ήχο και βίντεο σήμερα για να ξεκινήσετε.
Σταματήστε τη χειρωνακτική εργασία
Οι περισσότεροι μαθητές σπαταλούν χρόνο σε αναποτελεσματικές μεθόδους μάθησης
Αντί να διαβάζετε ξανά τα μεγάλα έγγραφά σας ή να δημιουργείτε με μη αυτόματο τρόπο κάρτες flash και περιλήψεις για ώρες, σας βοηθάμε να παραλείψετε αυτά τα βήματα.
Σταματήστε να πνίγεστε στις πληροφορίες και αφήστε το AI μας να φιλτράρει τι είναι πραγματικά σημαντικό. Ξεκινήστε γρήγορα να δοκιμάζετε τον εαυτό σας και βελτιωθείτε πιο γρήγορα.
Πολύ λίγοι άνθρωποι μπορούν να αντέξουν οικονομικά έναν προσωπικό δάσκαλο. Το StudyBlaze το αλλάζει για πάντα. Η διαδραστική μάθηση κάνει την πρόοδό σας 10 φορές πιο γρήγορη.
Η μη αυτόματη δημιουργία υλικού μελέτης είναι χρόνος που θα μπορούσατε να ξοδέψετε για εκπαίδευση και δοκιμή. Μειώστε το άγχος εξαλείφοντας εντελώς τη χειρωνακτική εργασία.
Ένας εκπαιδευτής AI διαθέσιμος 24/7
Έχετε πρόσβαση σε έναν δάσκαλο καθημερινά
Λάβετε άμεσα σχόλια για τις απαντήσεις σας
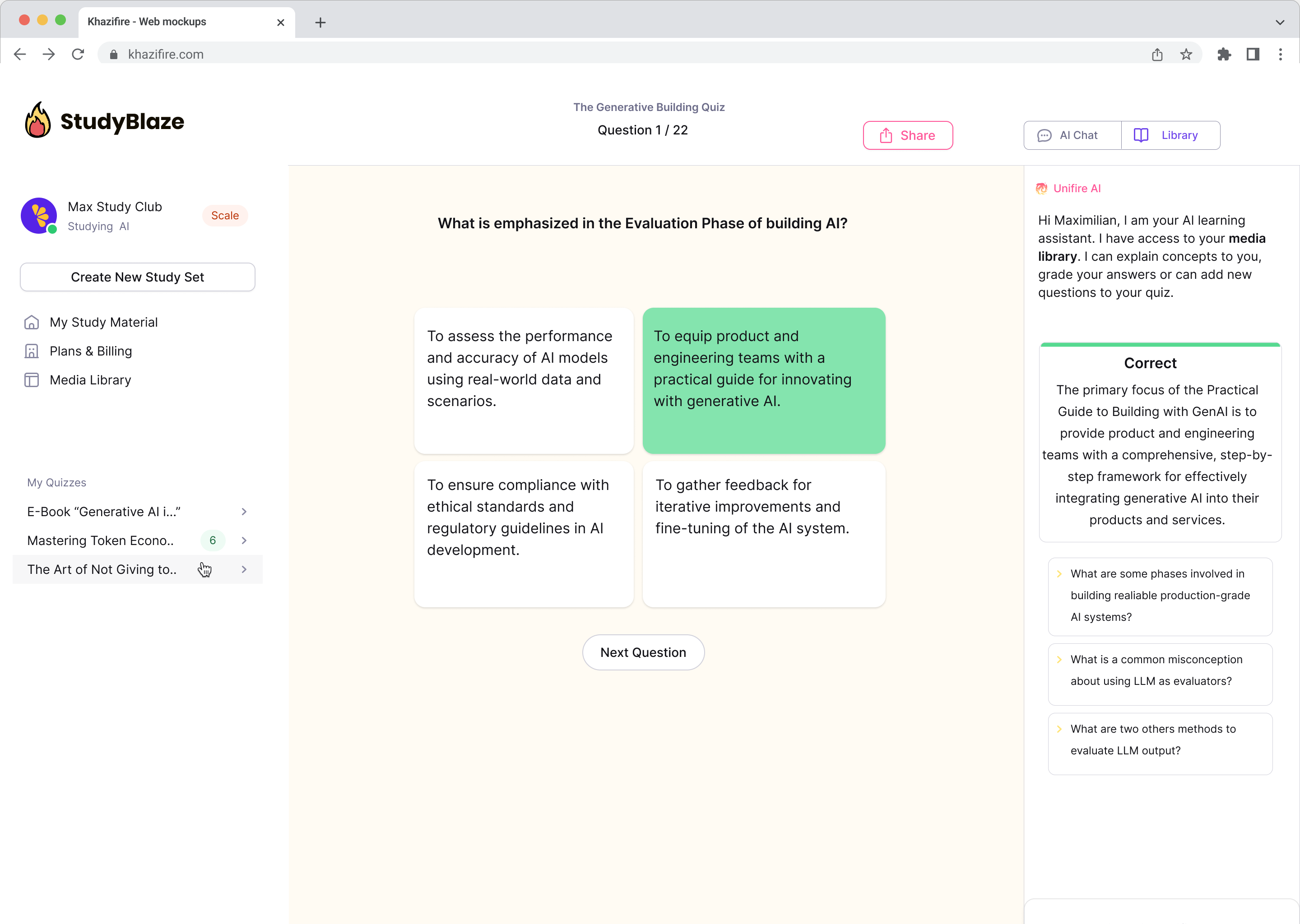
Συζητήστε με τα έγγραφά σας και κατανοήστε σύνθετα θέματα πιο γρήγορα
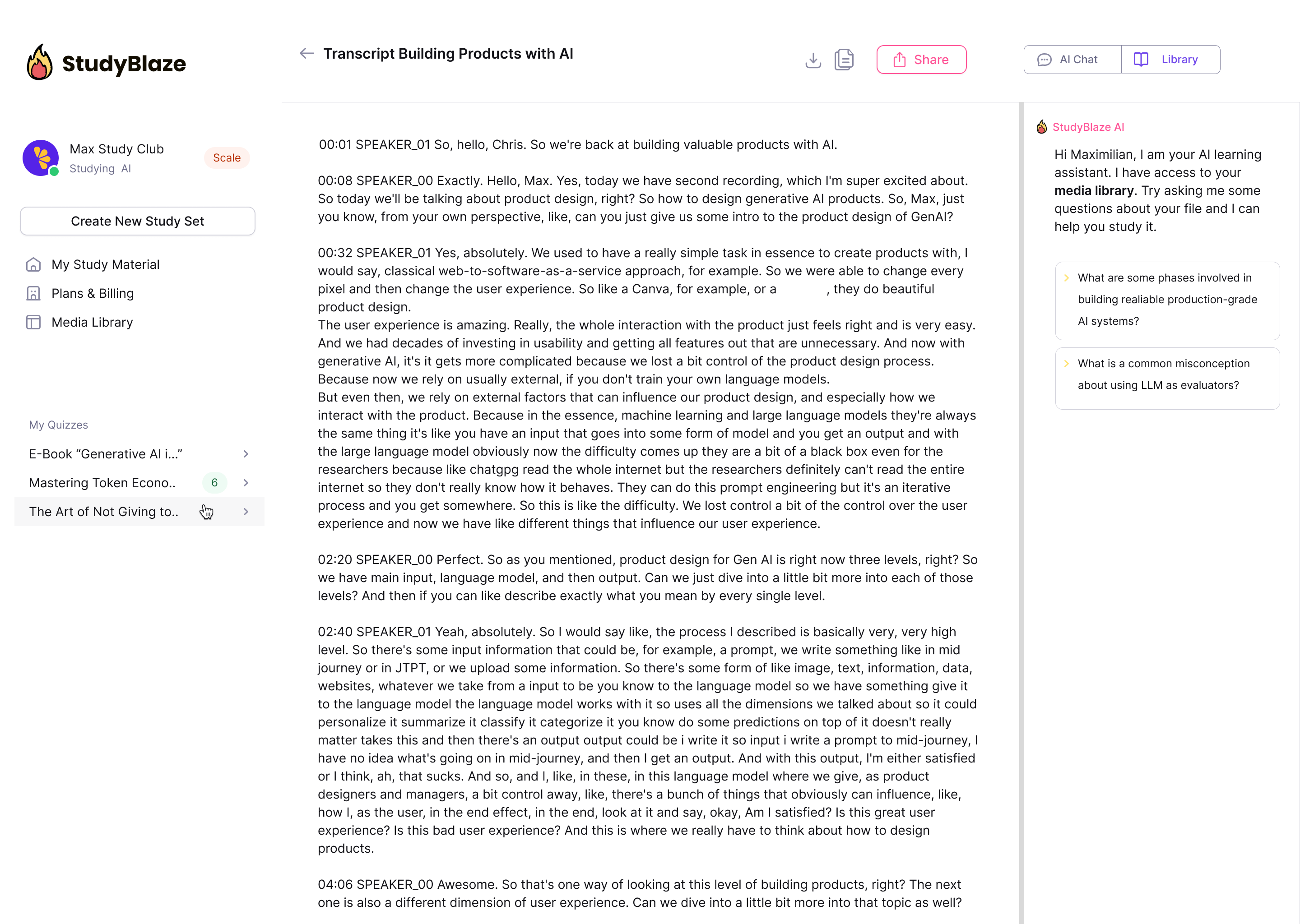
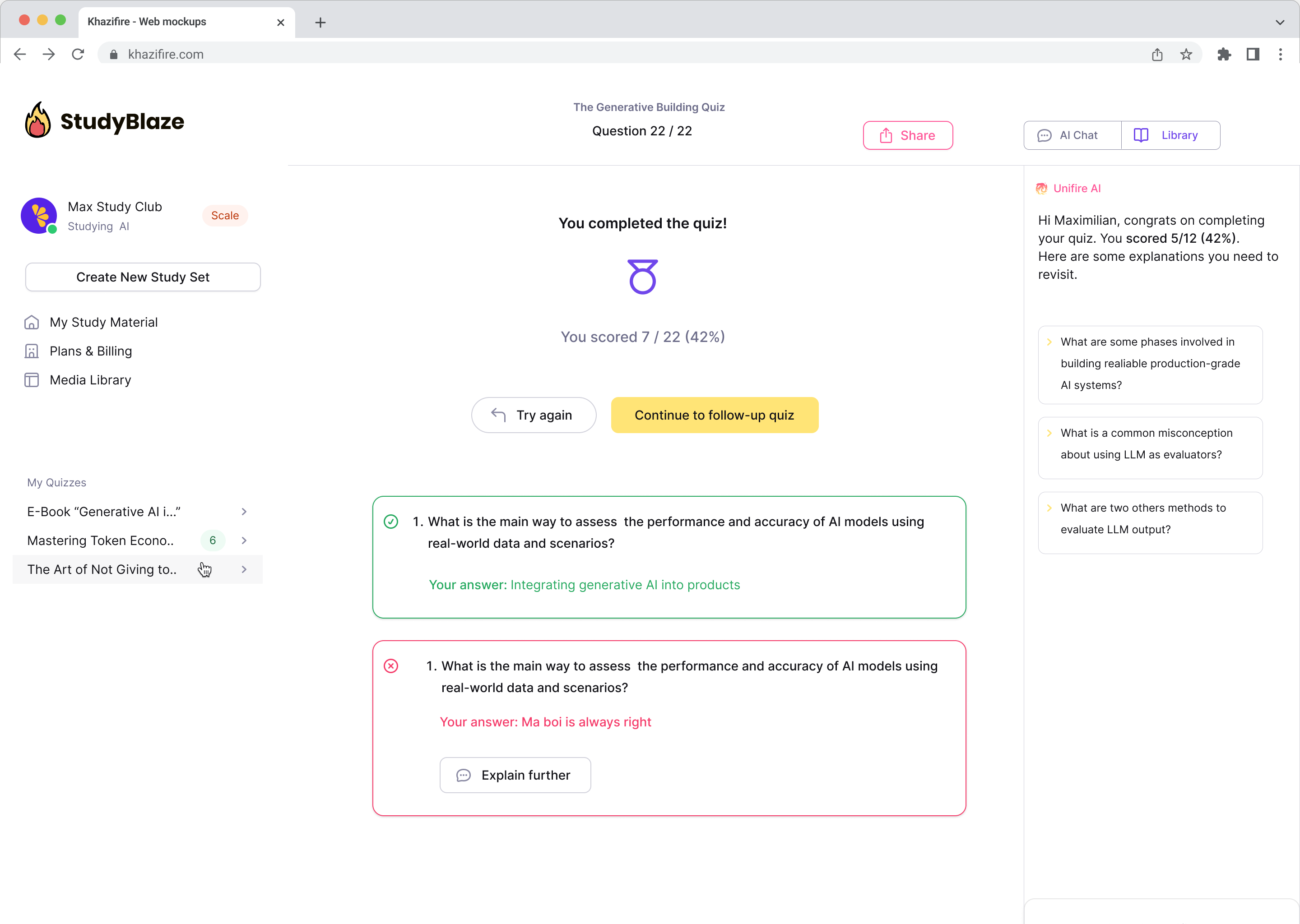
Αφήστε τον δάσκαλό σας AI να βαθμολογήσει τις απαντήσεις σας και να σας πει τι χάσατε
Οι πιο δημοφιλείς ερωτήσεις
Απαντάμε στις πιο σημαντικές ερωτήσεις χρηστών όπως εσείς.
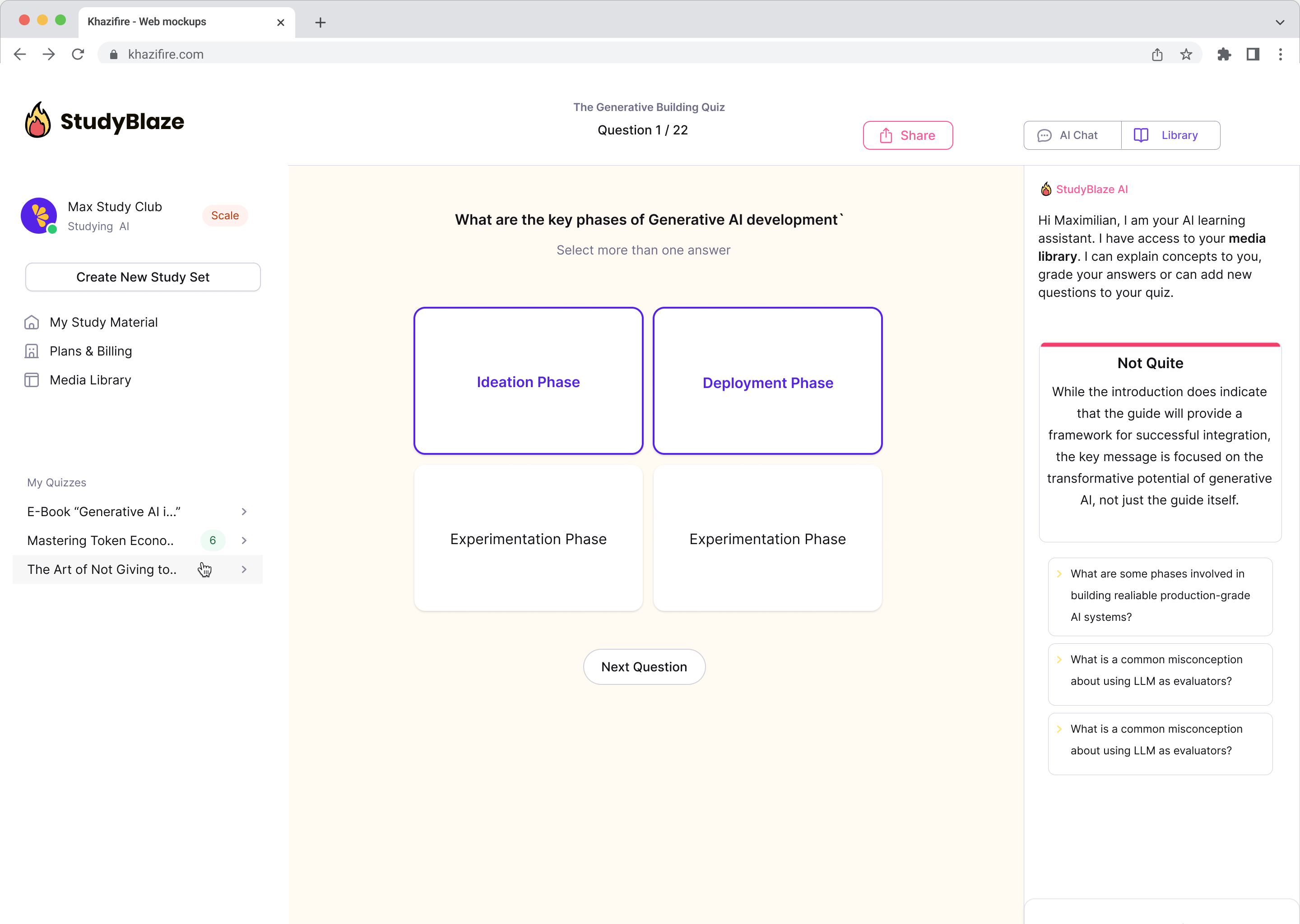
Αναβαθμίστε τις συνήθειές σας στη μελέτη
Με το StudyBlaze μπορείτε να βελτιώσετε αμέσως την ταχύτητα εκμάθησής σας. Αντί να διαβάζετε βαρετό υλικό ξανά και ξανά, δοκιμάστε τις γνώσεις σας πιο γρήγορα χωρίς ώρες χειροκίνητης δημιουργίας flashcard και περίληψης.
