KI-Generator für
Quiz, Karteikarten
& Mehr
Verwandeln Sie Ihre langweiligen Lerninhalte mit einem Klick in interaktive, KI-gestützte Arbeitsblätter, Tests, Lernkarten und Übungsfragen. Laden Sie noch heute PDFs, Dokumente, Audio- und Videodateien hoch, um loszulegen.
Schluss mit der Handarbeit
Die meisten Studenten verschwenden ihre Zeit mit ineffizienten Lernmethoden
Anstatt Ihre langen Dokumente erneut zu lesen oder stundenlang manuell Karteikarten und Zusammenfassungen zu erstellen, helfen wir Ihnen, diese Schritte zu überspringen.
Hören Sie auf, in Informationen zu ertrinken, und lassen Sie unsere KI das herausfiltern, was wirklich wichtig ist. Beginnen Sie schnell damit, sich selbst zu testen und verbessern Sie sich schneller.
Nur sehr wenige Menschen können sich einen Privatlehrer leisten. StudyBlaze ändert das für immer. Interaktives Lernen beschleunigt Ihren Fortschritt um das Zehnfache.
Das manuelle Erstellen von Lernmaterialien kostet Zeit, die Sie für das Training und Testen Ihrer selbst verwenden könnten. Reduzieren Sie Stress, indem Sie manuelle Arbeit vollständig vermeiden.
Ein KI-Tutor ist rund um die Uhr verfügbar
Jeden Tag Zugang zu einem Tutor
Erhalten Sie sofortiges Feedback zu Ihren Antworten
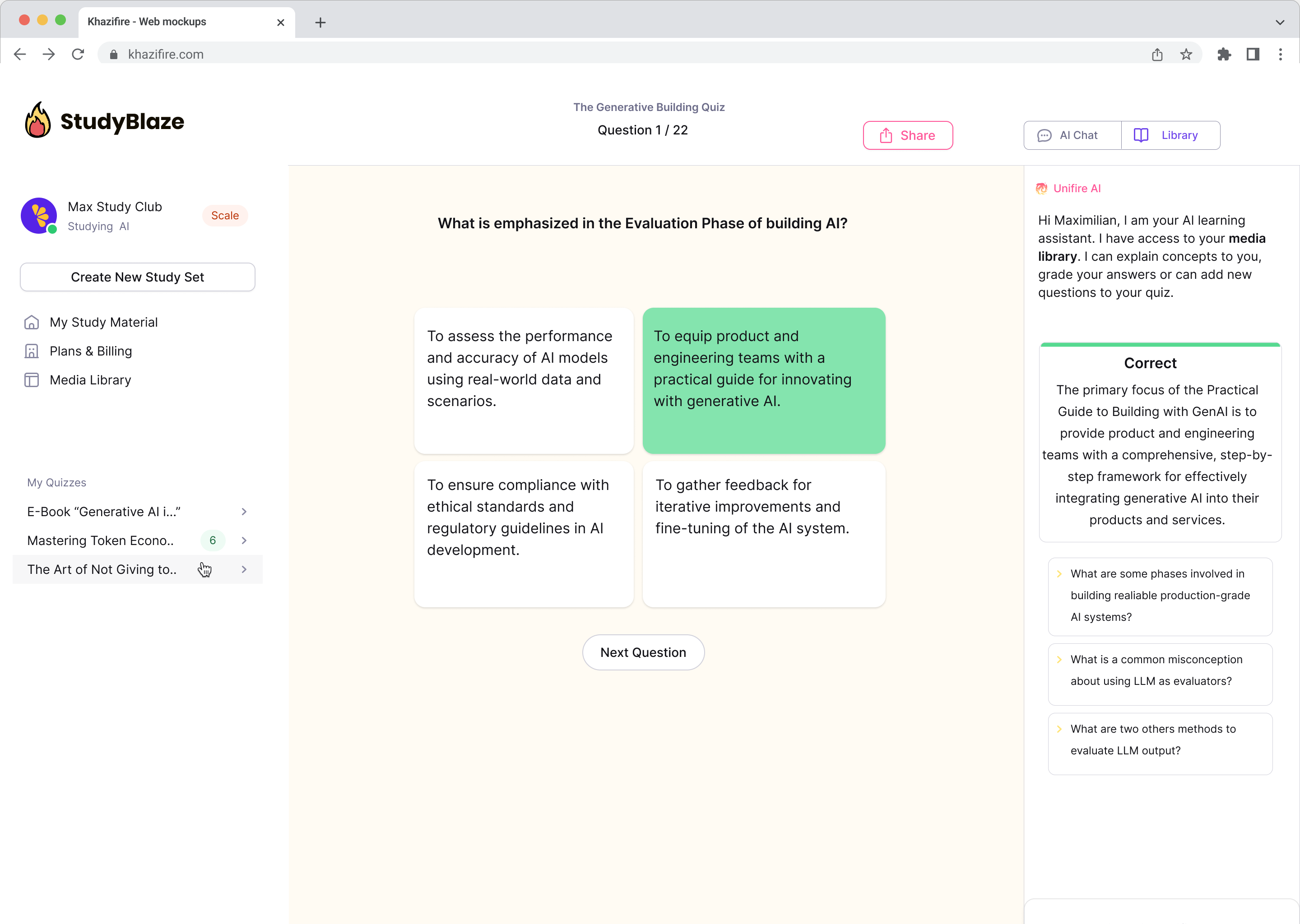
Chatten Sie mit Ihren Dokumenten und verstehen Sie komplexe Themen schneller
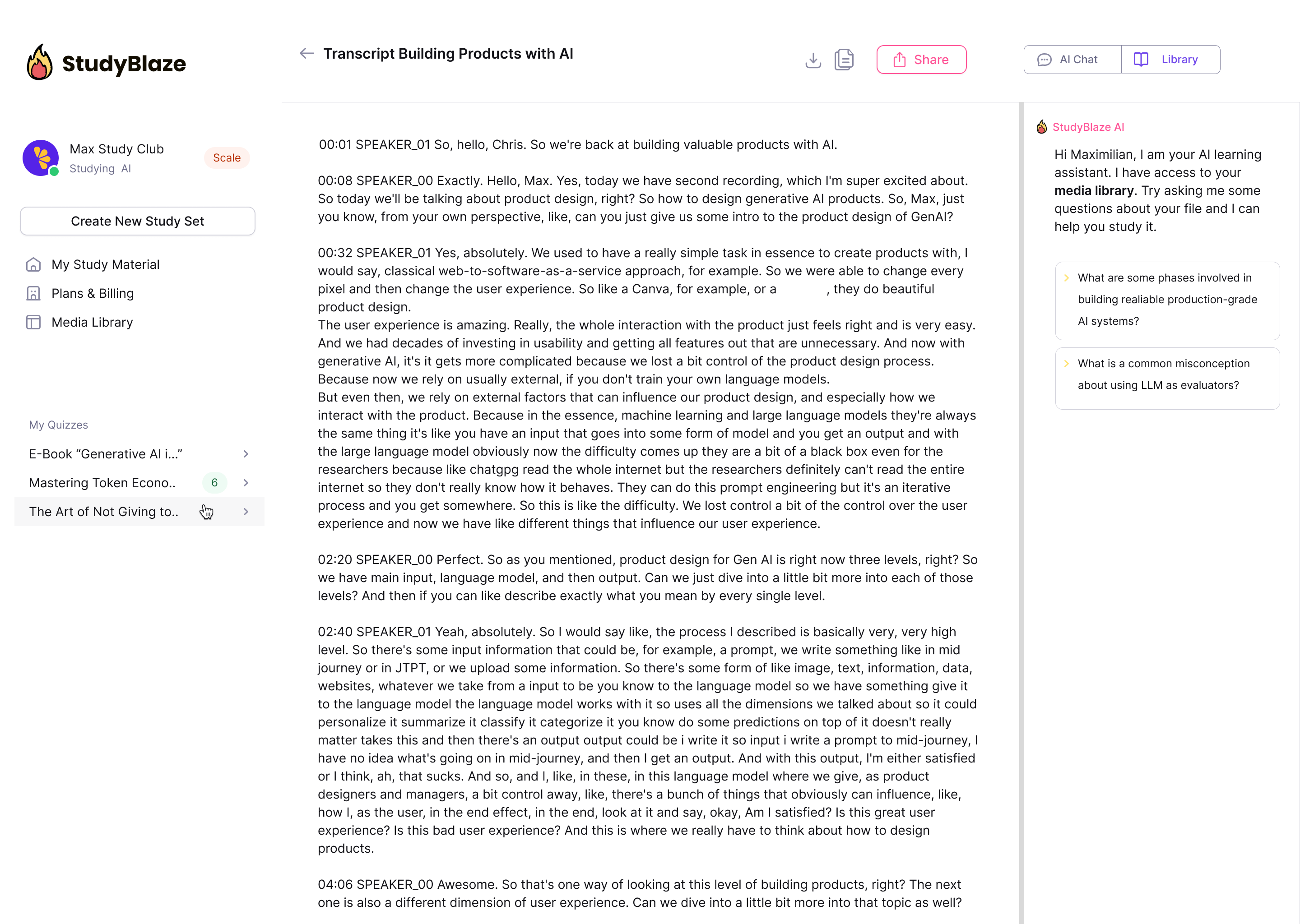
Lassen Sie Ihren KI-Tutor Ihre Antworten bewerten und Ihnen sagen, was Sie verpasst haben
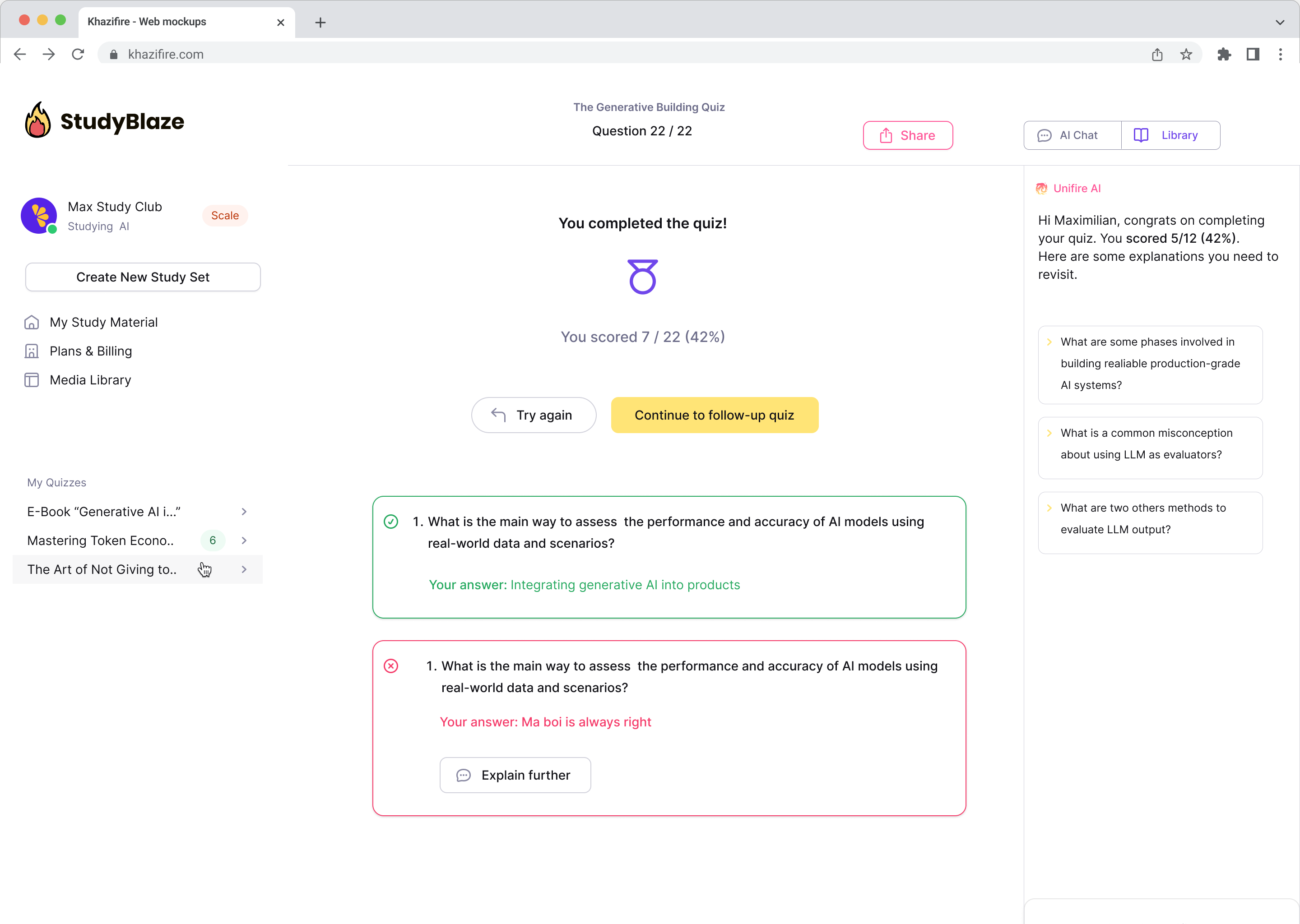
Die beliebtesten Fragen
Wir beantworten die wichtigsten Fragen von Anwendern wie Ihnen.
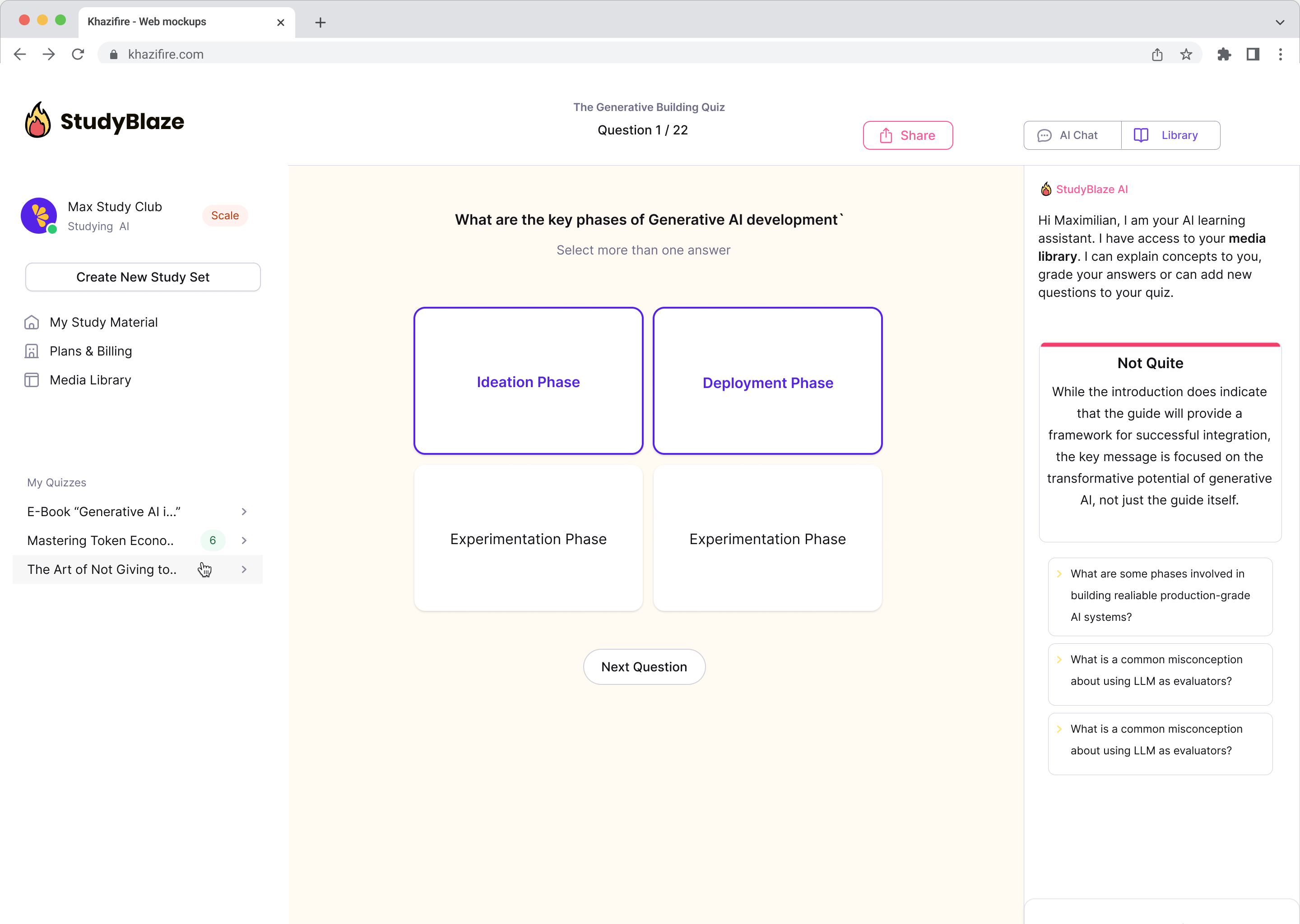
Verbessern Sie Ihre Lerngewohnheiten
Mit StudyBlaze können Sie Ihre Lerngeschwindigkeit sofort verbessern. Anstatt langweilige Materialien immer wieder zu lesen, können Sie Ihr Wissen schneller testen, ohne stundenlang manuell Karteikarten und Zusammenfassungen erstellen zu müssen.
