AI Generator til
Quizzer, Flashcards
& Mere
Forvandl dit kedelige studieindhold til interaktive AI-drevne arbejdsark, quizzer, flashcards og øvelsesspørgsmål med et klik på en knap. Upload PDF'er, dokumenter, lyd og video i dag for at komme i gang.
Stop det manuelle arbejde
De fleste elever spilder tid på ineffektive læringsmetoder
I stedet for at genlæse dine lange dokumenter eller manuelt oprette flashcards og resuméer i timevis, hjælper vi dig med at springe disse trin over.
Stop med at drukne i information, og lad vores AI filtrere det, der virkelig er vigtigt, fra. Kom hurtigt i gang med at teste dig selv og forbedre dig hurtigere.
Meget få mennesker har råd til en personlig vejleder. StudyBlaze ændrer dette for altid. Interaktiv læring gør dine fremskridt 10x hurtigere.
Manuel oprettelse af studiematerialer er tid, som du kan bruge på at træne og teste dig selv. Reducer stress ved helt at eliminere manuelt arbejde.
En AI Tutor tilgængelig 24/7
Har adgang til en vejleder hver dag
Modtag øjeblikkelig feedback på dine svar
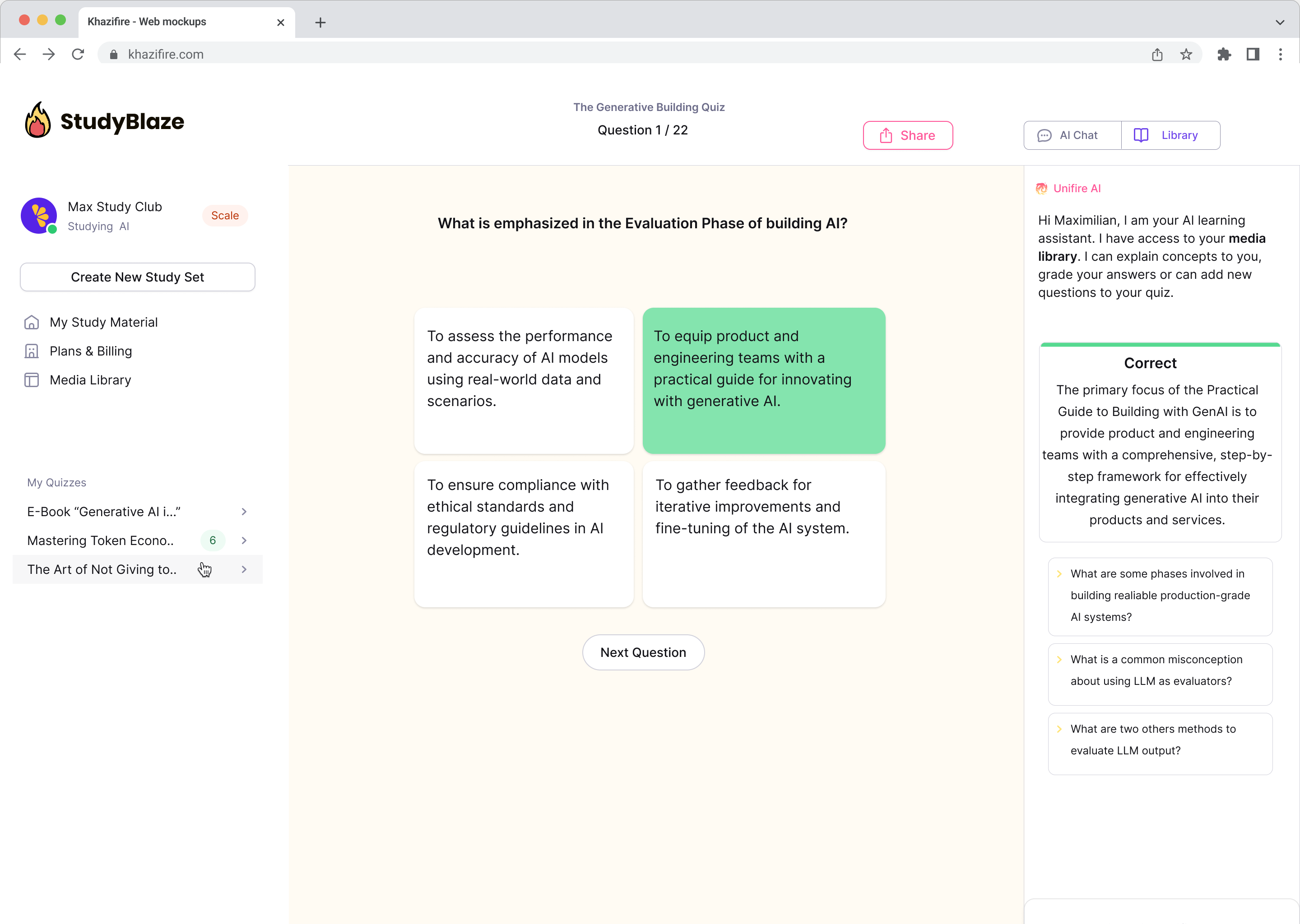
Chat med dine dokumenter og forstå komplekse emner hurtigere
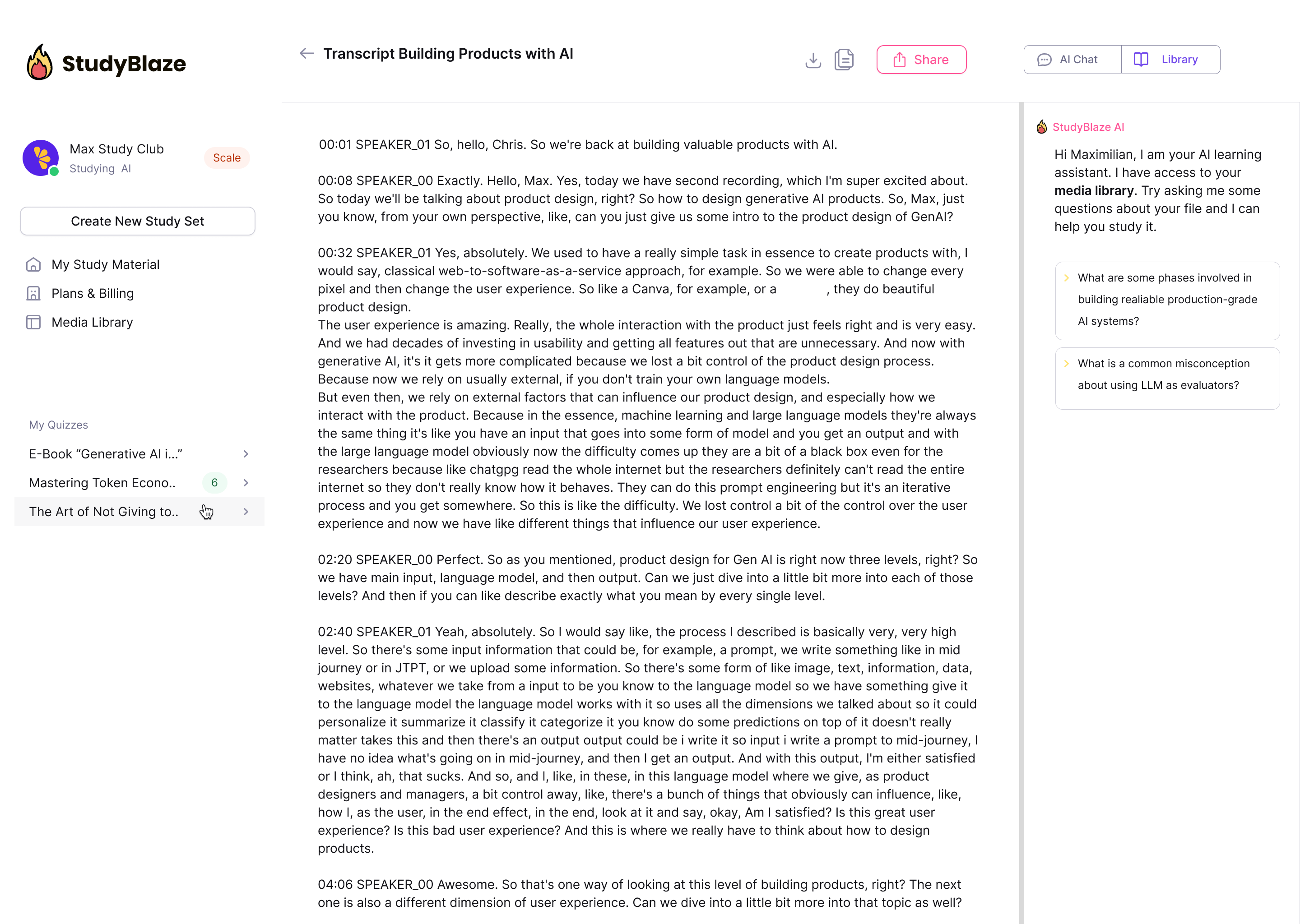
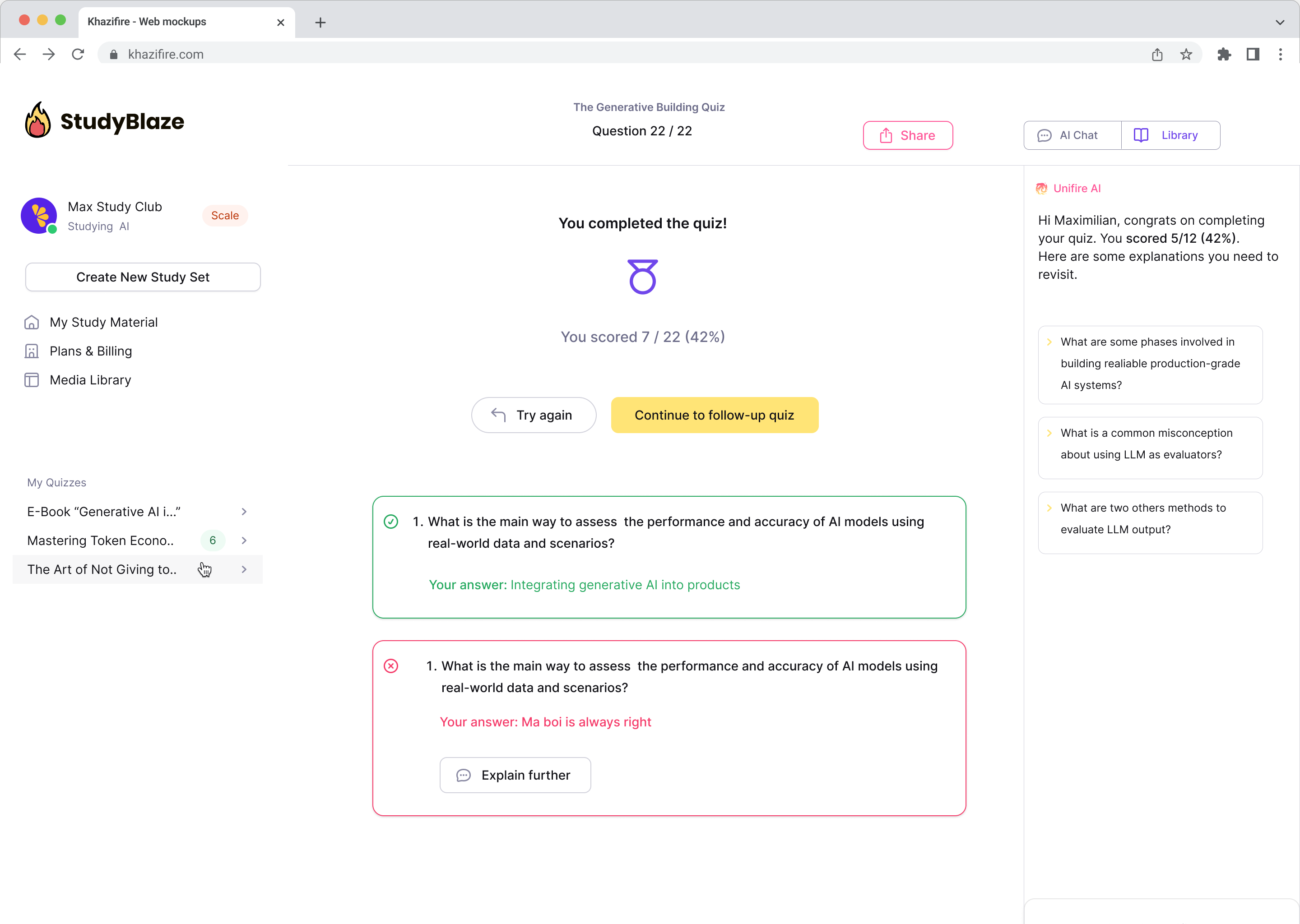
Lad din AI-vejleder bedømme dine svar og fortælle dig, hvad du gik glip af
Mest populære spørgsmål
Vi besvarer de vigtigste spørgsmål, som brugere som dig har.
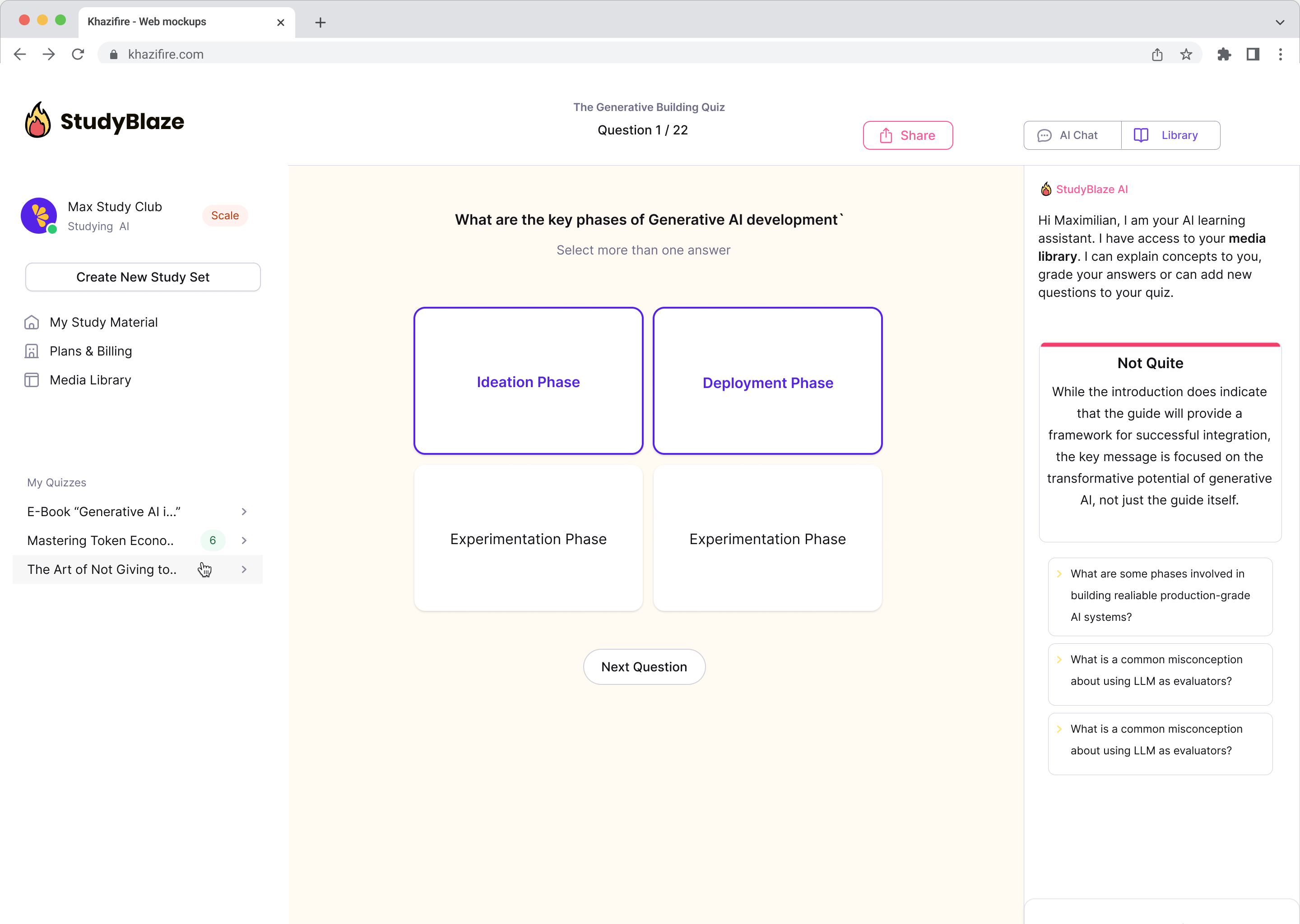
Opgrader dine studievaner
Med StudyBlaze kan du straks forbedre din lærehastighed. I stedet for at læse kedeligt materiale igen og igen, kan du få testet din viden hurtigere uden timers manuel flashkort og oversigtsoprettelse.
