Generátor AI pro
Kvízy, kartičky
& Více
Přeměňte svůj nudný studijní obsah na interaktivní pracovní listy, kvízy, kartičky a procvičovací otázky založené na umělé inteligenci jediným kliknutím. Chcete-li začít, nahrajte soubory PDF, dokumenty, zvuk a video ještě dnes.
Zastavte manuální práci
Většina studentů ztrácí čas neefektivními metodami učení
Namísto opakovaného čtení dlouhých dokumentů nebo ručního vytváření kartiček a shrnutí vám pomůžeme tyto kroky přeskočit.
Přestaňte se topit v informacích a nechte naši AI filtrovat to, co je opravdu důležité. Rychle se začněte testovat a rychleji se zdokonalujte.
Osobního učitele si může dovolit jen málokdo. StudyBlaze to navždy změní. Interaktivní učení dělá váš pokrok 10x rychlejší.
Ruční vytváření studijních materiálů je čas, který byste mohli věnovat školení a testování sami. Snižte stres úplným vyloučením manuální práce.
Tutor AI je k dispozici 24/7
Mít každodenní přístup k lektorovi
Získejte okamžitou zpětnou vazbu na své odpovědi
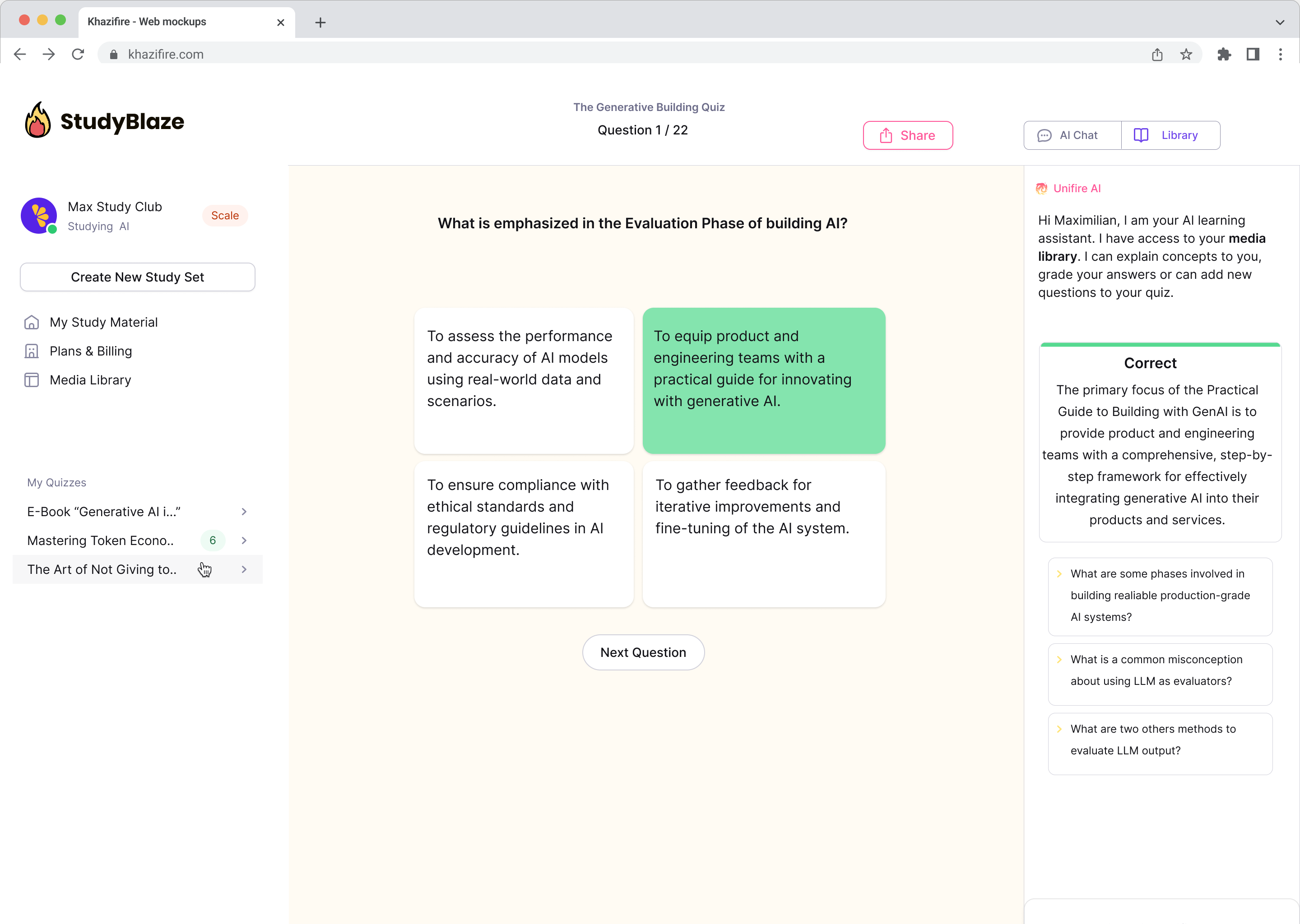
Chatujte se svými dokumenty a rychleji pochopte složitá témata
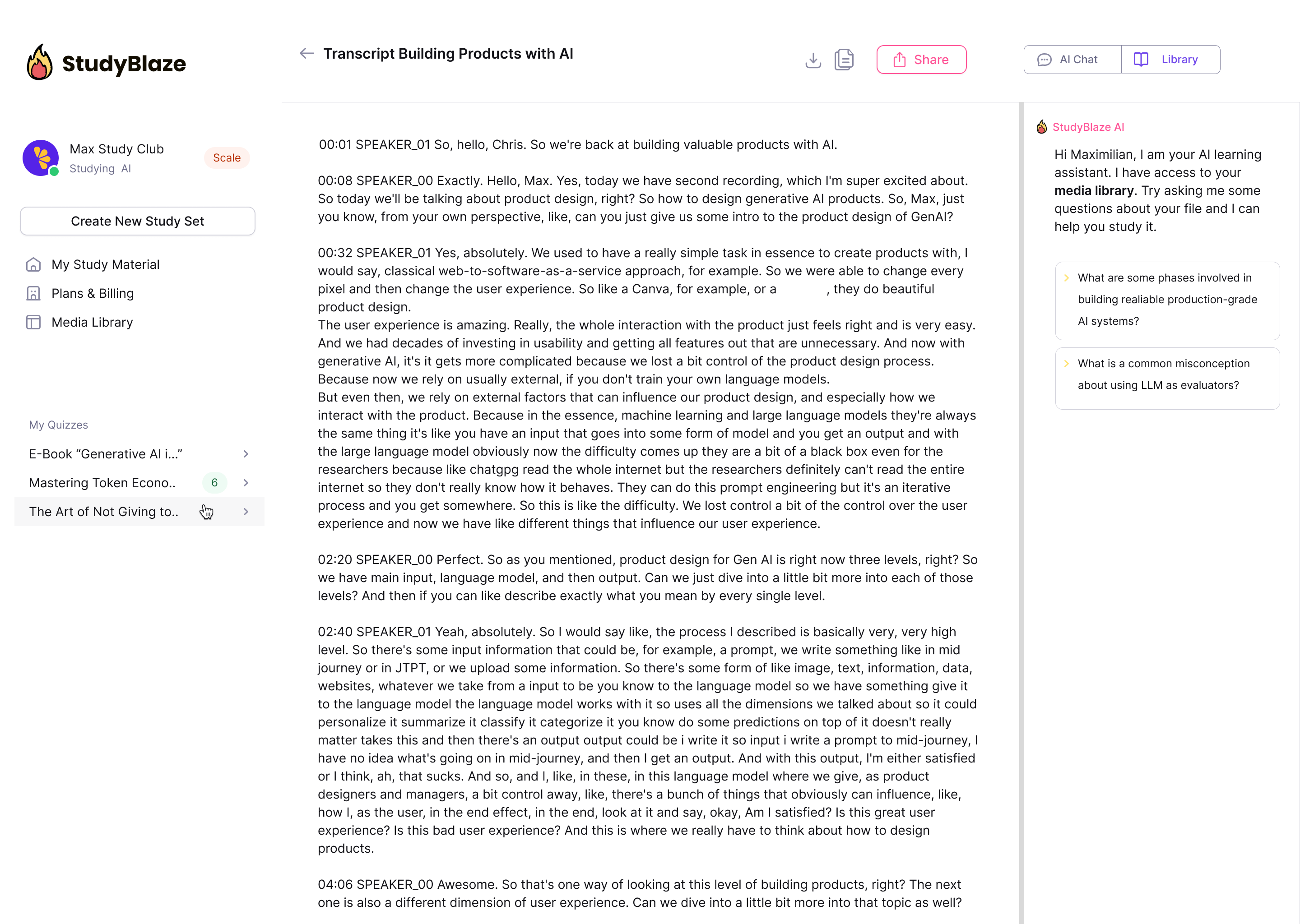
Nechte svého učitele umělé inteligence, aby ohodnotil vaše odpovědi a řekl vám, co vám uniklo
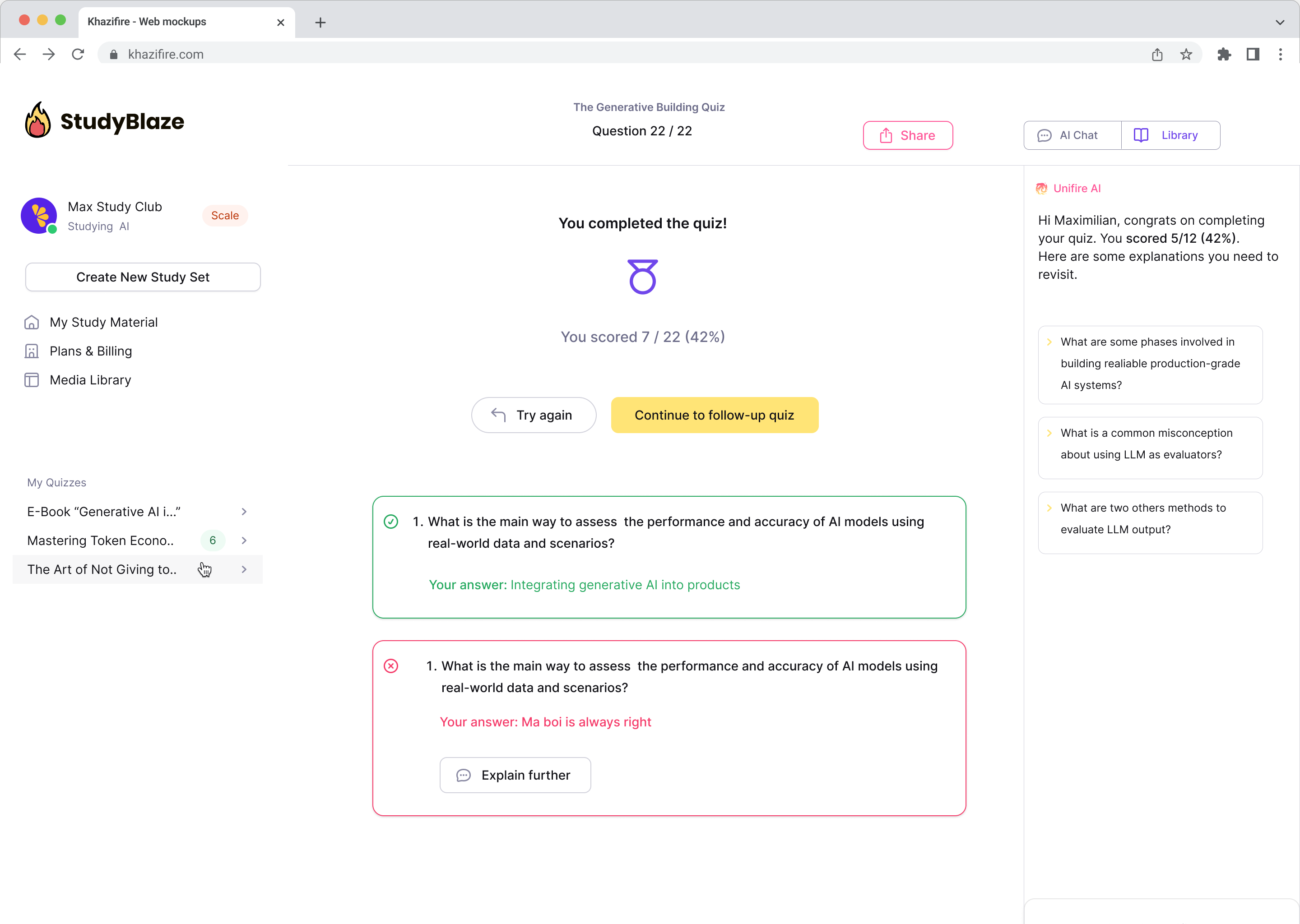
Nejoblíbenější otázky
Odpovídáme na nejdůležitější otázky uživatelů, jako jste vy.
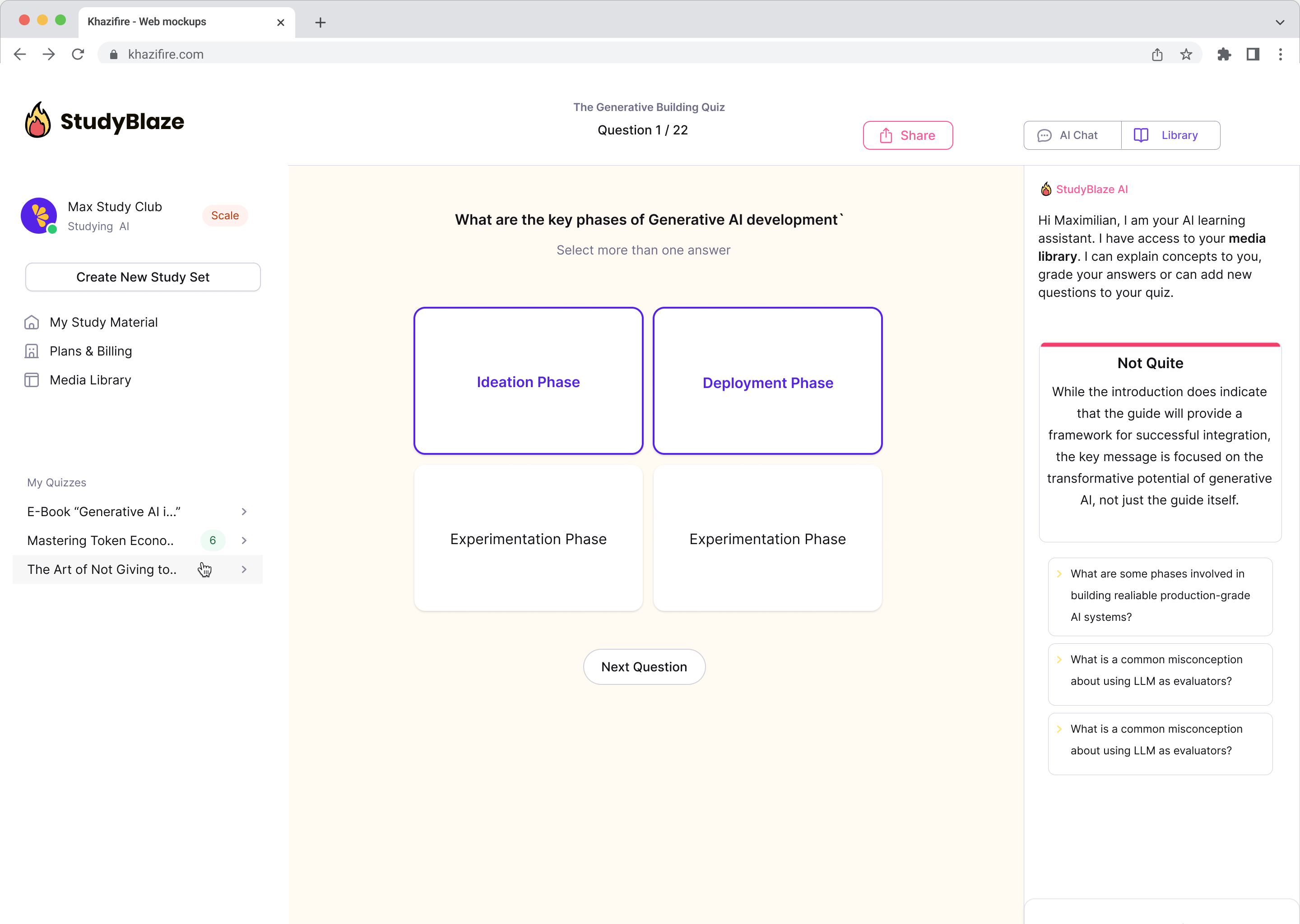
Upgradujte své studijní návyky
S StudyBlaze můžete okamžitě zlepšit rychlost učení. Namísto opakovaného čtení nudných materiálů si otestujte své znalosti rychleji bez hodin ručního vytváření kartiček a shrnutí.
